
有机化学重排反应 总结.pdf

文库****品店




亲,该文档总共24页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

有机化学重排反应总结.doc
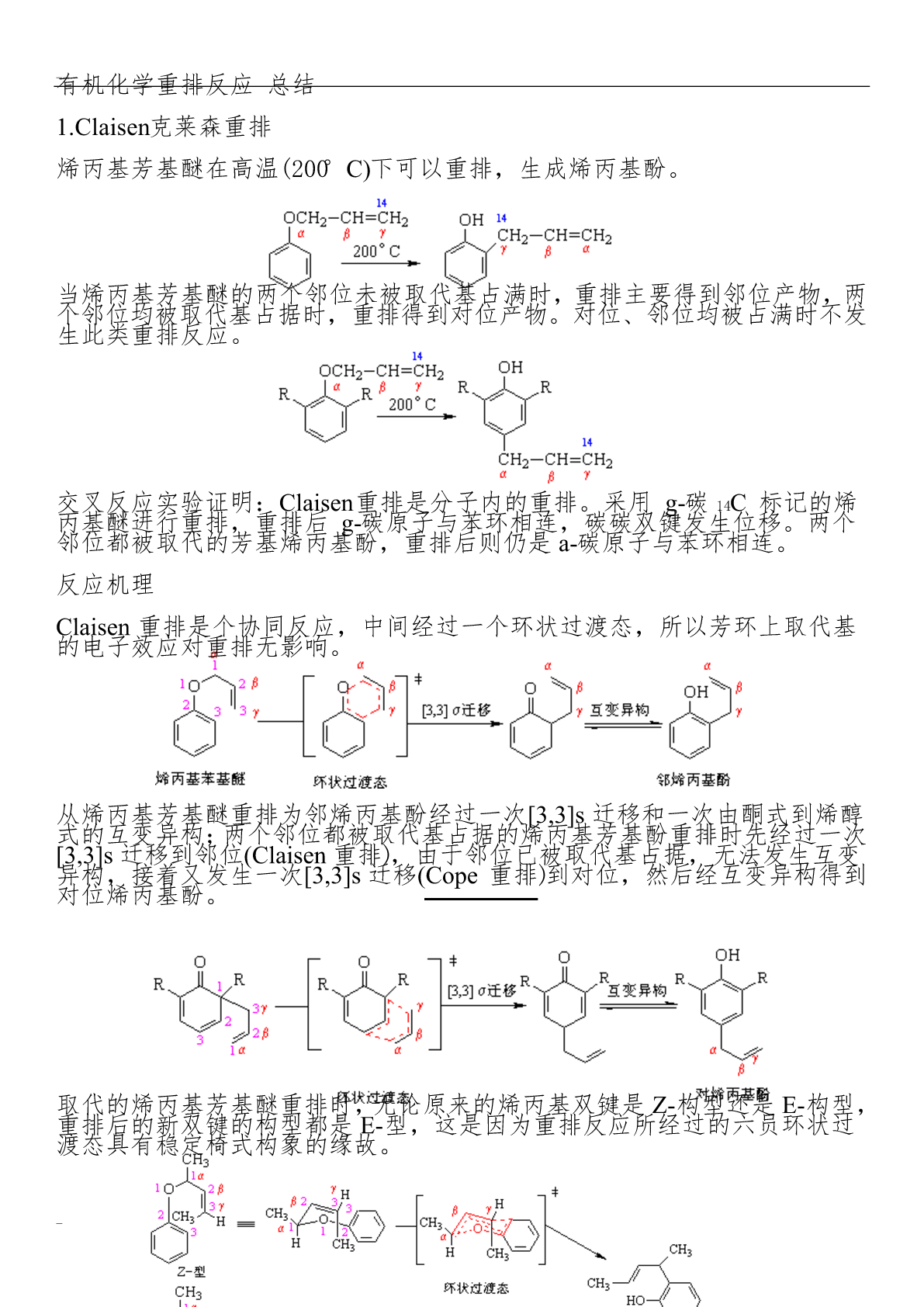
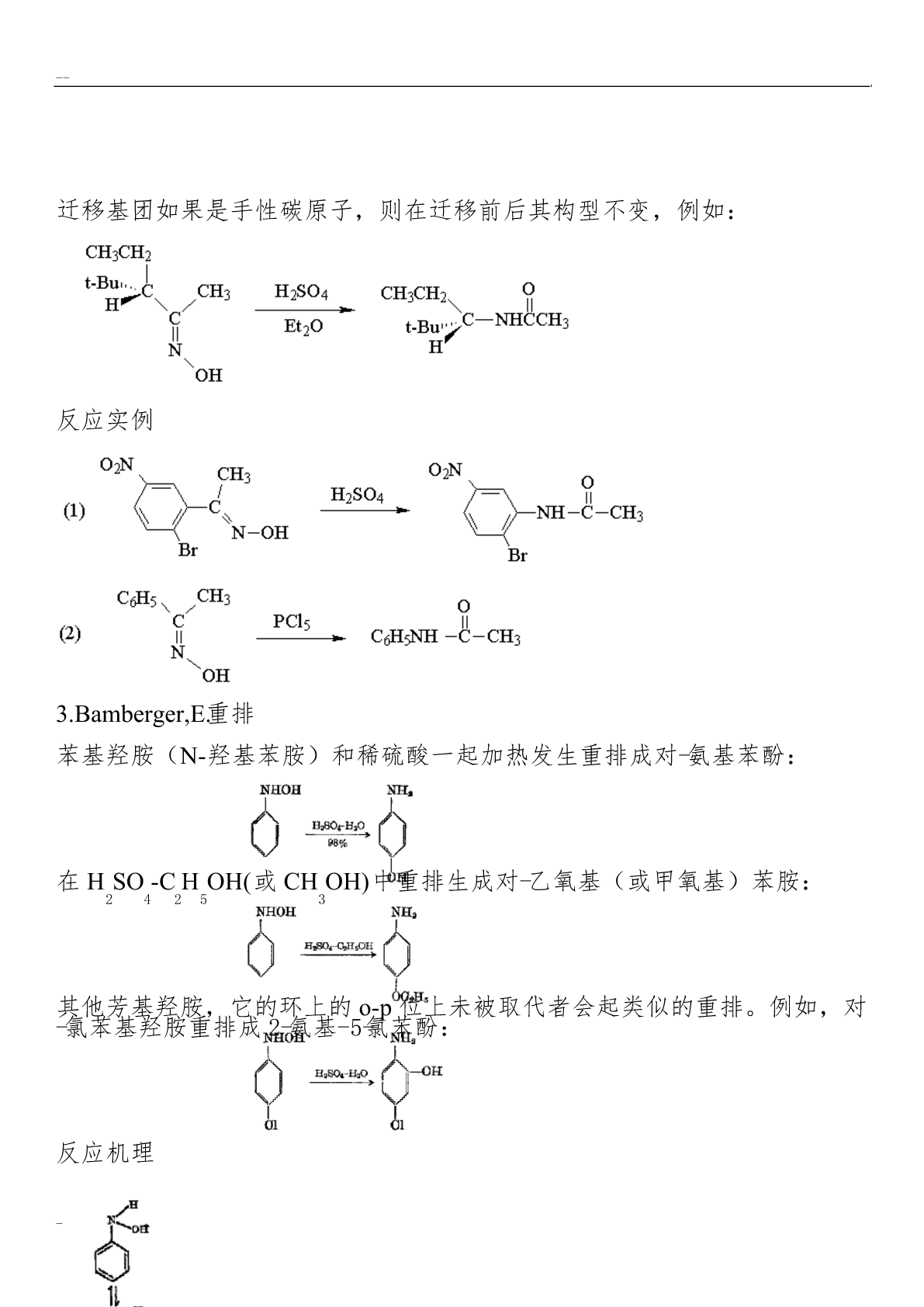
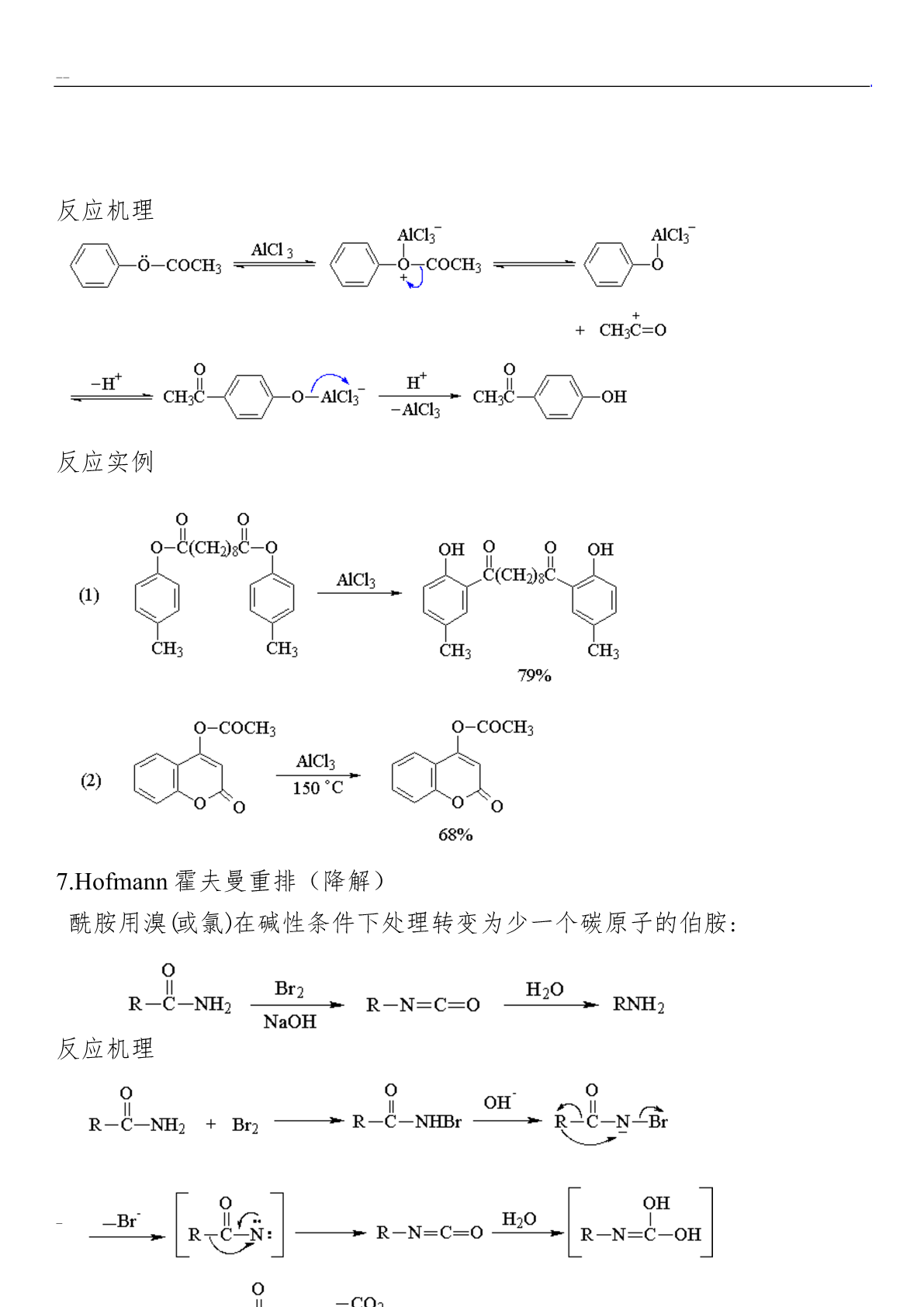
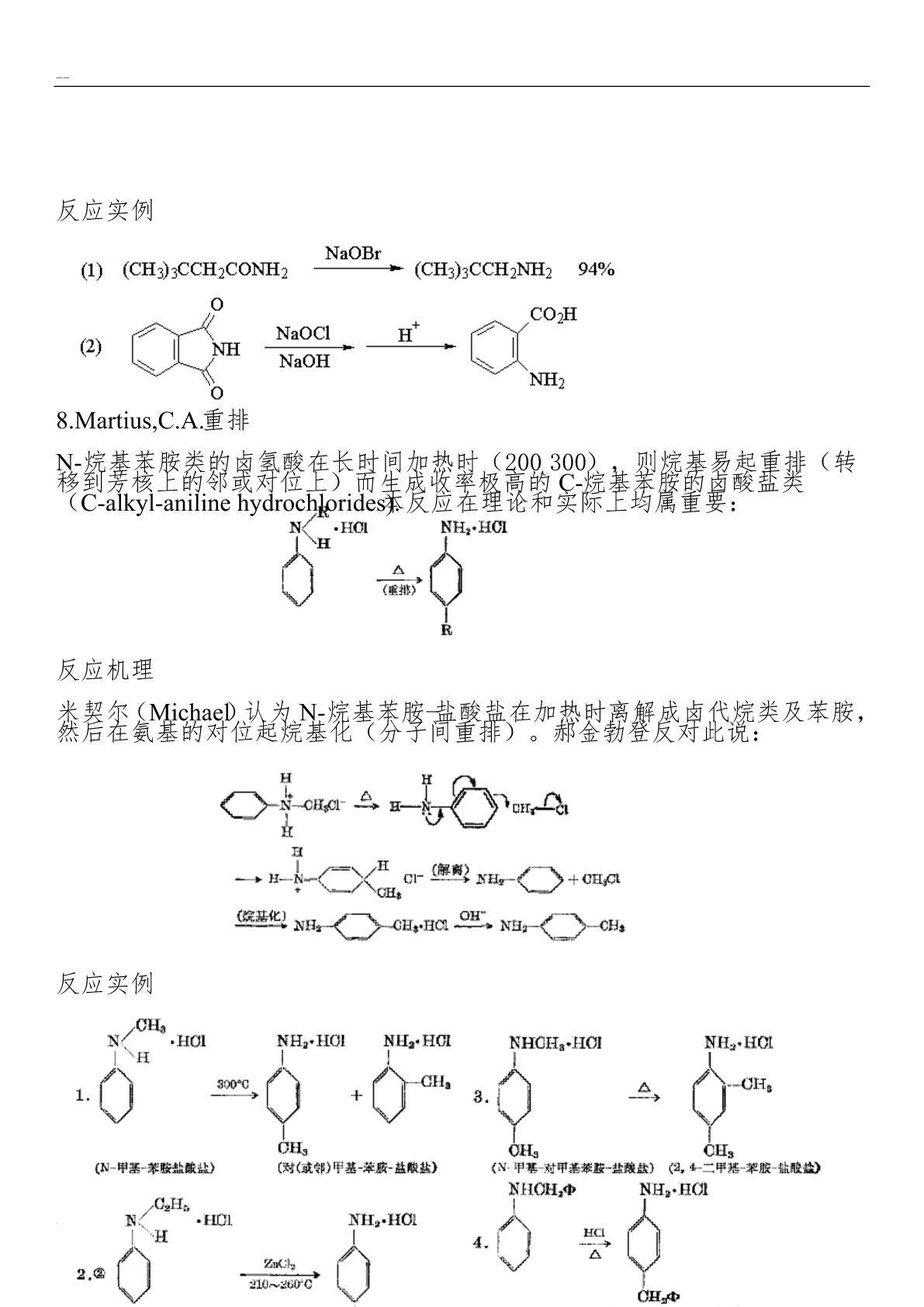
有机化学重排反应总结克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。交叉反应实验证明:Claisen重排是分子内的重排。采用g-碳14C标记的烯丙基醚进行重排,重排后g-碳原子与苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。反应机理Claisen重排是个协同反应,中间经过一个环状过渡态,所以芳

有机化学重排反应 总结.pdf
有机化学重排反应--总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。交叉反应实验证明:Claisen重排是分子内的重排。采用g-碳14C标记的烯丙基醚进行重排,重排后g-碳原子与苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。反应机理Claisen重排是个协同反应,中间经过

有机化学重排反应工作总结.doc
有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。交叉反应实验证明:Claisen重排是分子内的重排。采用g-碳14C标记的烯丙基醚进行重排,重排后g-碳原子与苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。反应机理Claisen重排是个协同反应,中间经过一个

(完整版)有机化学重排反应总结.doc
有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。交叉反应实验证明:Claisen重排是分子内的重排。采用g-碳14C标记的烯丙基醚进行重排,重排后g-碳原子与苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。反应机理Claisen重排是个协同反应,中间经过一个

考研-有机化学反应机理-重排反应.ppt
有机反应反应机理重排反应反应机理是对一个反应过程的详细描述,在表述反应机理时,必须指出电子的流向,并规定用箭头表示一对电子的转移,用鱼钩箭头表示单电子的转移。反应机理是根据很多实验事实总结后提出的,它有一定的适用范围,能解释很多实验事实,并能预测反应的发生。如果发现新的实验事实无法用原有的反应机理来解释,就要提出新的反应机理。反应机理已成为有机结构理论的一部分。重排反应(1)频哪醇重排(2)异丙苯氧化重排(3)贝克曼重排(4)法沃斯基重排(5)拜耳-魏立格氧化重排(6)霍夫曼重排(7)二苯乙醇酸重排(8)
