
【精选】药物合成反应》第3章酰化反应.ppt

是浩****32



亲,该文档总共93页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

【精选】药物合成反应》第3章酰化反应.ppt
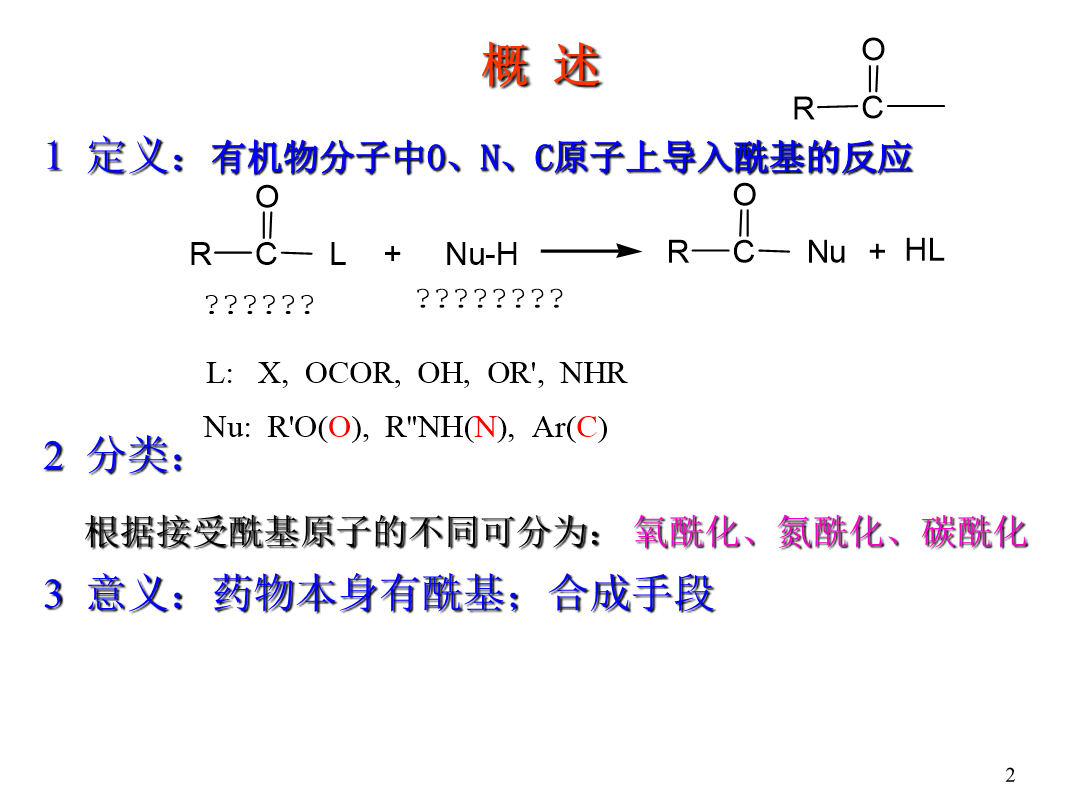
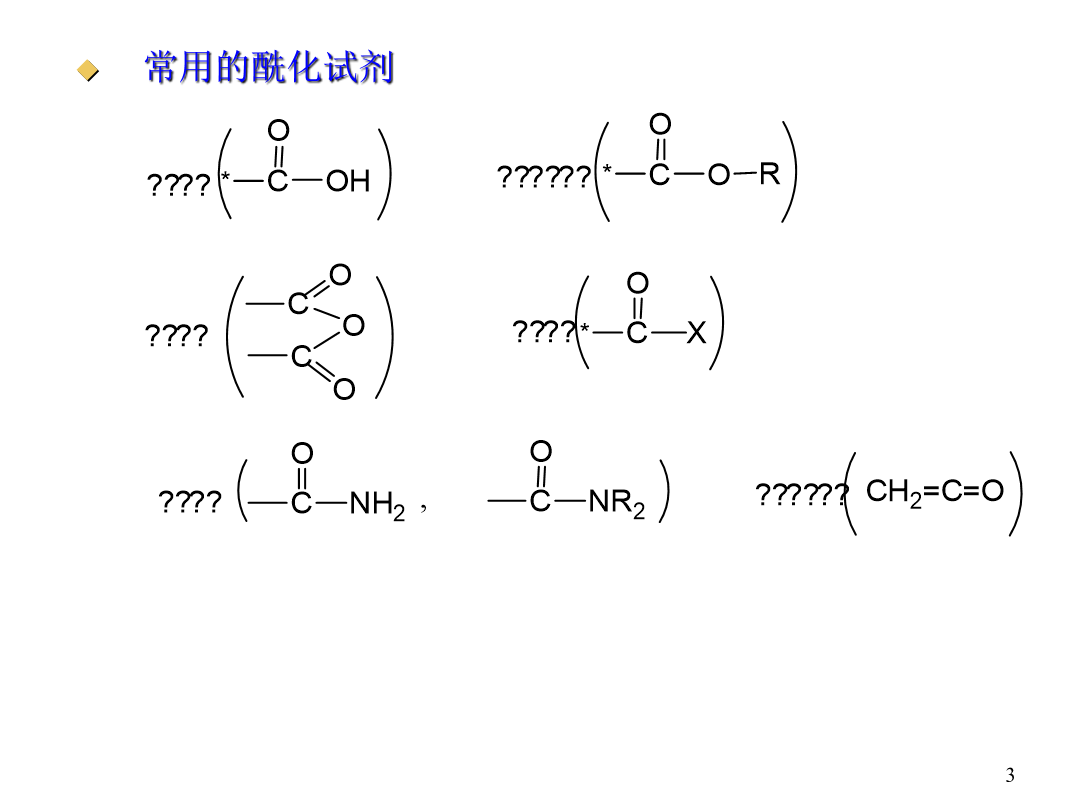
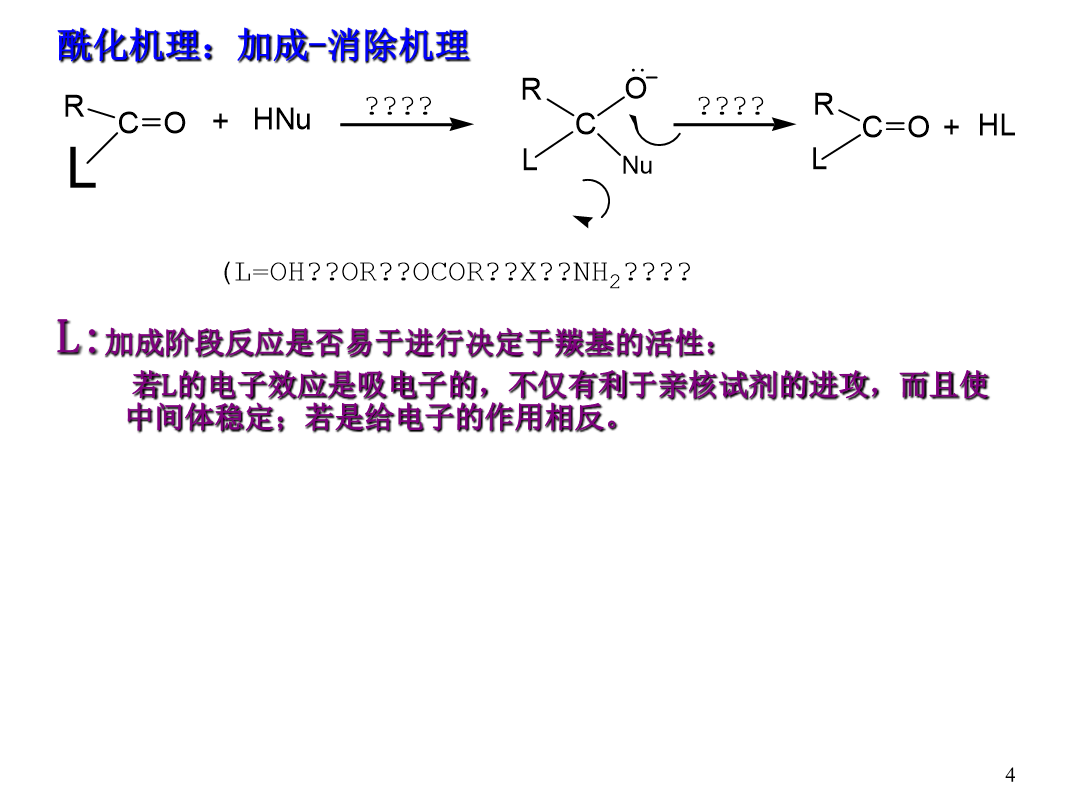
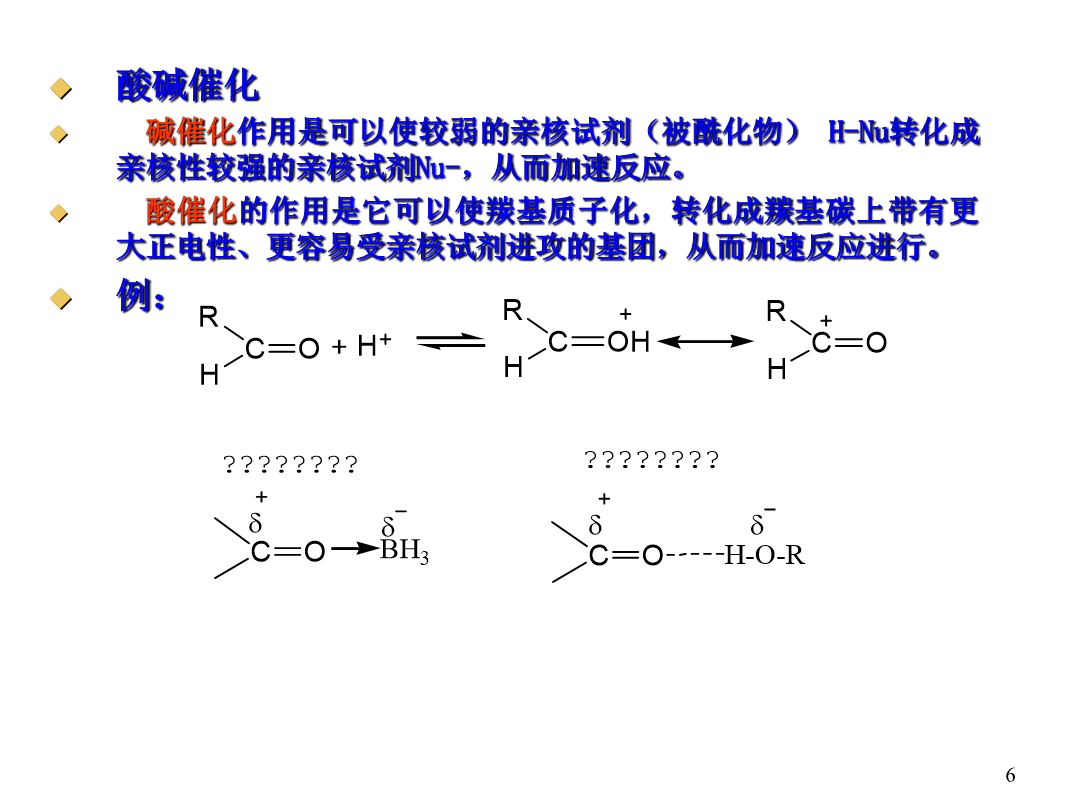
ChapterThird概述常用的酰化试剂酰化机理:加成-消除机理L:加成阶段反应是否易于进行决定于羰基的活性:若L的电子效应是吸电子的不仅有利于亲核试剂的进攻而且使中间体稳定;若是给电子的作用相反。在消除阶段反应是否易于进行主要取决于L的离去倾向。L-碱性越强越不容易离去CI-是很弱的碱-OCOR的碱性较强些OH-、OR-是相当强的碱NH2-是更强的碱。∴RCOCI>(RCO)2O>RCOOH、RCOOR′>RCONH2>RCONR2′R:R带吸

【精选】药物合成反应》第3章酰化反应.ppt
ChapterThird概述常用的酰化试剂酰化机理:加成-消除机理L:加成阶段反应是否易于进行决定于羰基的活性:若L的电子效应是吸电子的不仅有利于亲核试剂的进攻而且使中间体稳定;若是给电子的作用相反。在消除阶段反应是否易于进行主要取决于L的离去倾向。L-碱性越强越不容易离去CI-是很弱的碱-OCOR的碱性较强些OH-、OR-是相当强的碱NH2-是更强的碱。∴RCOCI>(RCO)2O>RCOOH、RCOOR′>RCONH2>RCONR2′R:R带吸

药物合成反应酰化反应.ppt
药物合成反应酰化反应羧酸为酰化剂羧酸为酰化剂羧酸为酰化剂羧酸为酰化剂羧酸为酰化剂羧酸为酰化剂羧酸酯酰化剂羧酸酯酰化剂羧酸酯酰化剂酸酐做酰化剂酸酐做酰化剂酰氯为酰化剂酰氯为酰化剂酰胺做酰化剂羧酸为酰化剂羧酸酯酰化剂酸酐做酰化剂酰氯为酰化剂酰胺做酰化剂芳烃碳旳酰化芳烃碳旳酰化芳烃碳旳酰化芳烃碳旳酰化芳烃碳旳酰化芳烃碳旳酰化芳烃碳旳酰化芳烃碳旳酰化烯烃碳旳烃化羰基α位旳烃化羰基α位旳烃化羰基α位旳烃化羰基α位旳烃化羰基α位旳烃化羰基α位旳烃化

酰化反应-药物合成反应.ppt
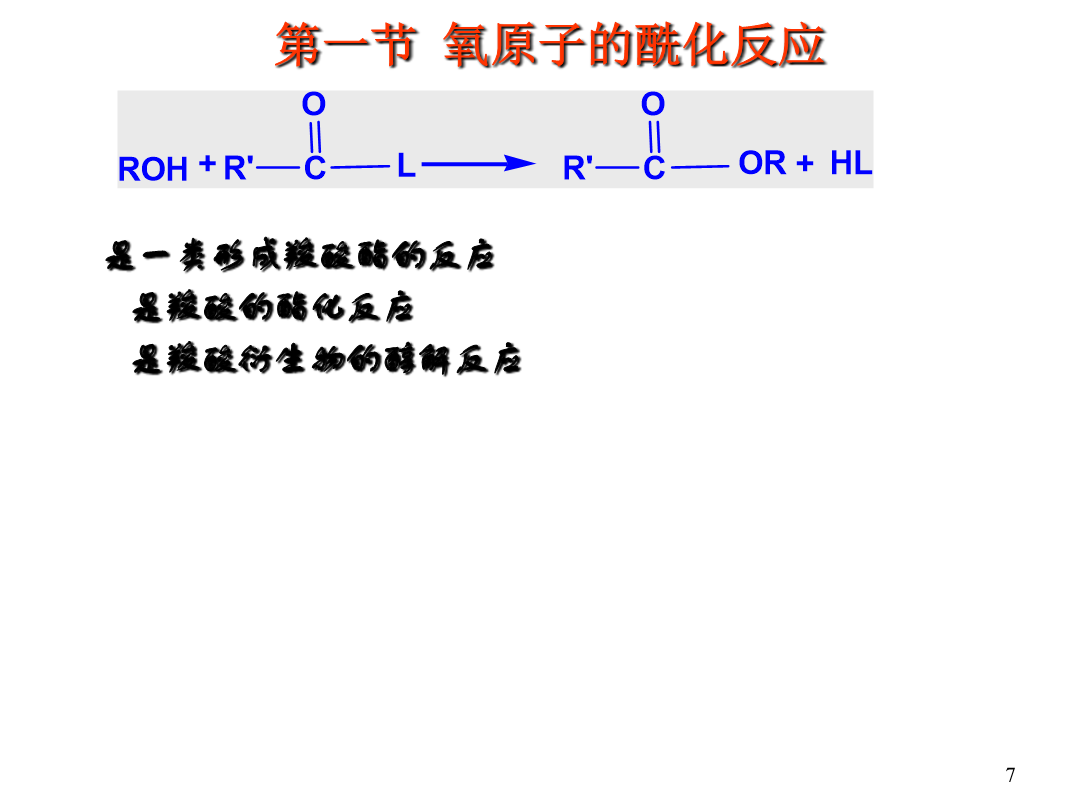
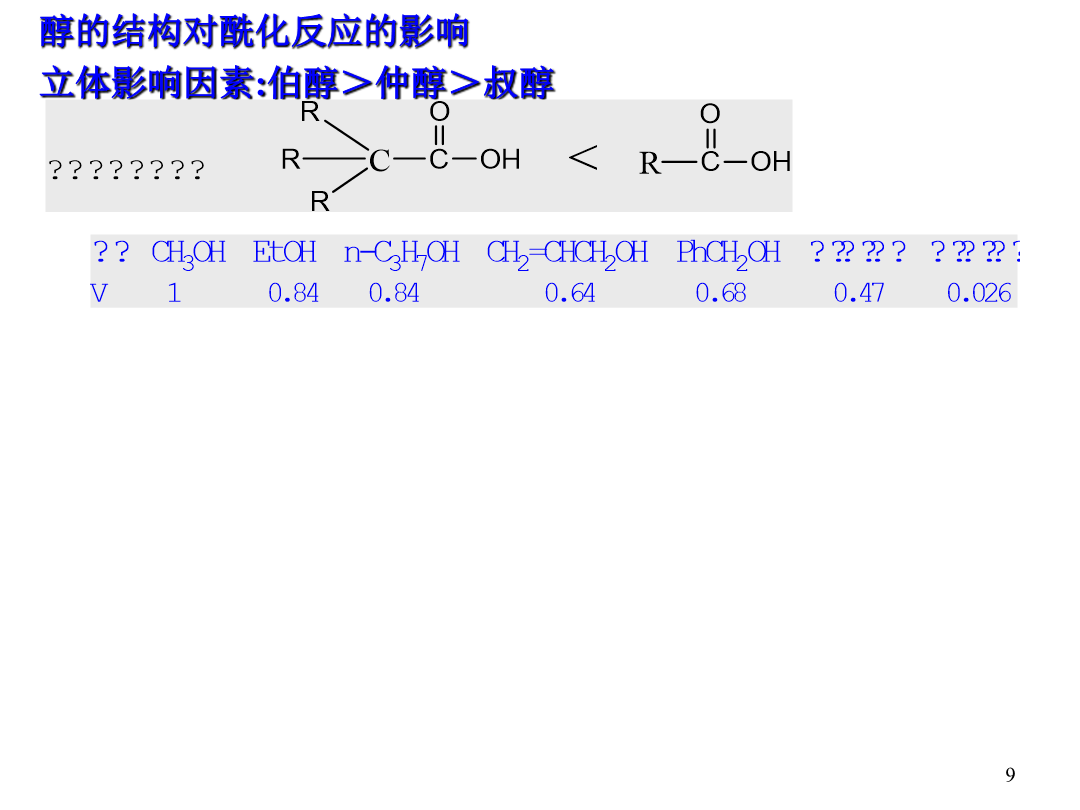
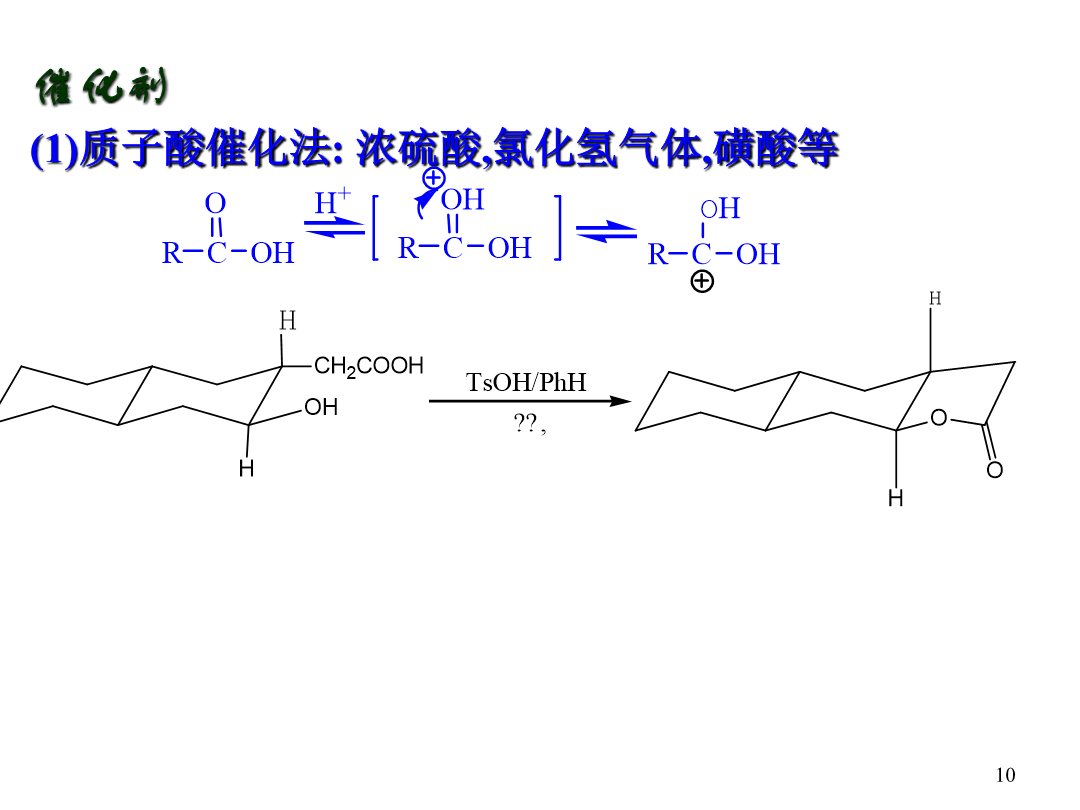
Chapter3AcylationReaction酰化反应:酰基的引入方式:直接酰化法和间接酰化法直接自由基酰化:间接酰化法:将酰基的等价体与有机化合物相结合,结构中潜在的被隐蔽的酰基经过处理可以恢复成酰基间接亲电酰化:7第三章酰化反应氧原子上的酰化反应(酯的制备)提高收率:(1)增加反应物浓度(2)不断蒸出反应产物之一(3)添加脱水剂或分子筛除水(无水CuSO4,无水Al2(SO4)3,(CF3CO)2O,DCC等)加快反应速率:(1)提高温度(2)催化剂(降低活化能)醇的结构对酰化反应的影响立体影响因

药物合成酰化反应.pptx
概述2分类:依据接收酰基原子不一样可分为:氧酰化、氮酰化、碳酰化3用途:药品本身有酰基活性化合物必要官能团结构修饰和前体药品(如棕榈酸氯霉素)羟基、胺基等基团保护,官能团转化药物合成酰化反应概述惯用酰化试剂第一节酰化反应机理药物合成酰化反应(3)酰化剂强弱次序(4)被酰化物活性第二节氧原子酰化反应1、羧酸为酰化剂提升收率:(1)增加反应物浓度(2)不停蒸出反应产物之一(3)共沸除水、添加脱水剂或分子筛除水。(无水CuSO4,无水Al2(SO4)3,(CF3CO)2O,DCC。)加紧反应速率:(1)提升温度
