
(北京专用)高考化学一轮复习 专题十六 电化学课件-人教版高三全册化学课件.pptx

雨巷****珺琦





亲,该文档总共133页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

(北京专用)高考化学一轮复习 专题十六 电化学课件-人教版高三全册化学课件.pptx
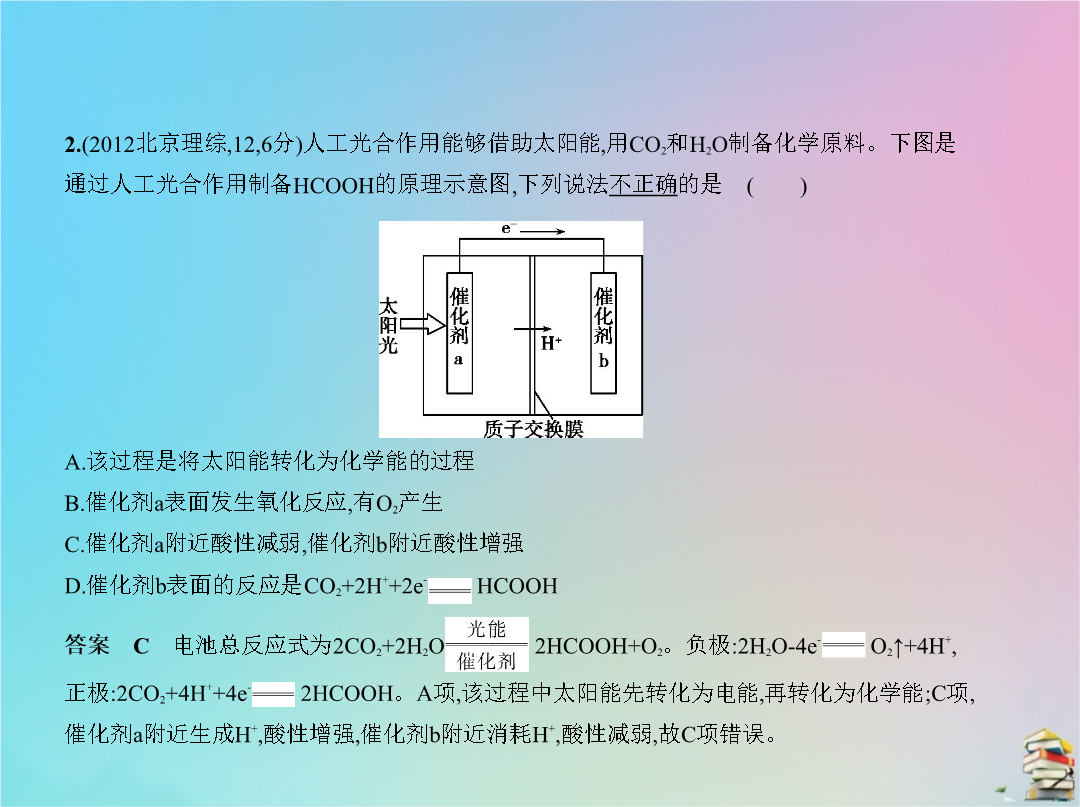
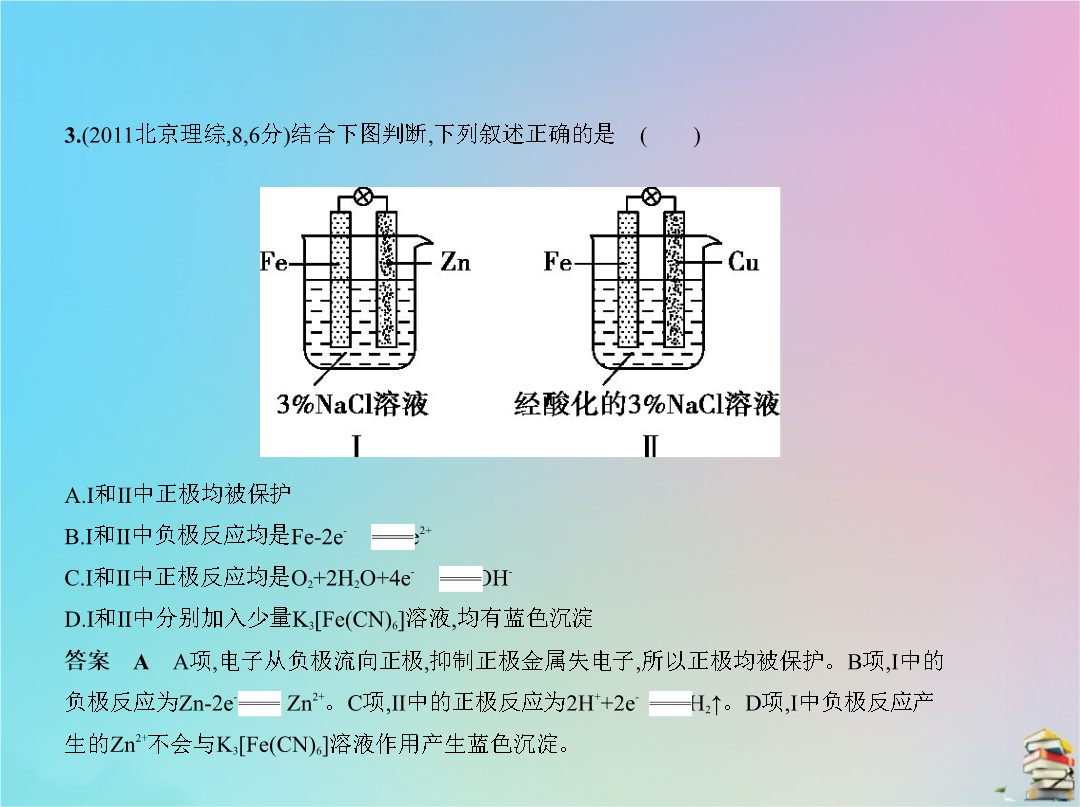
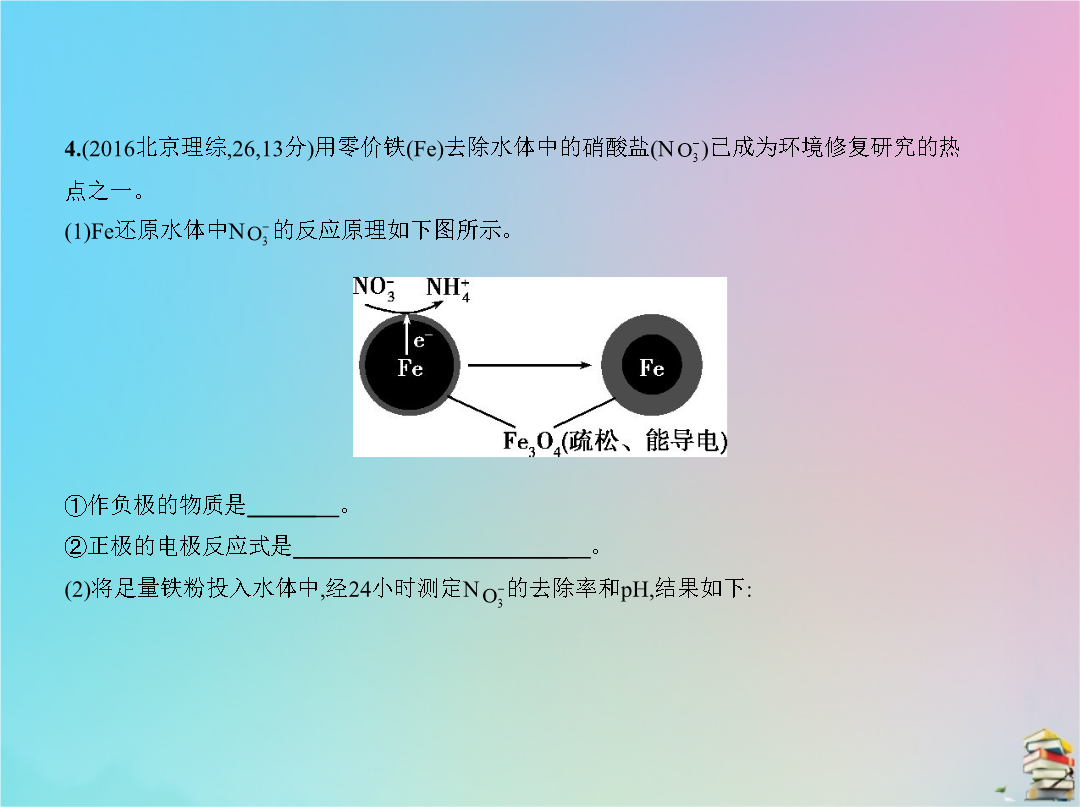
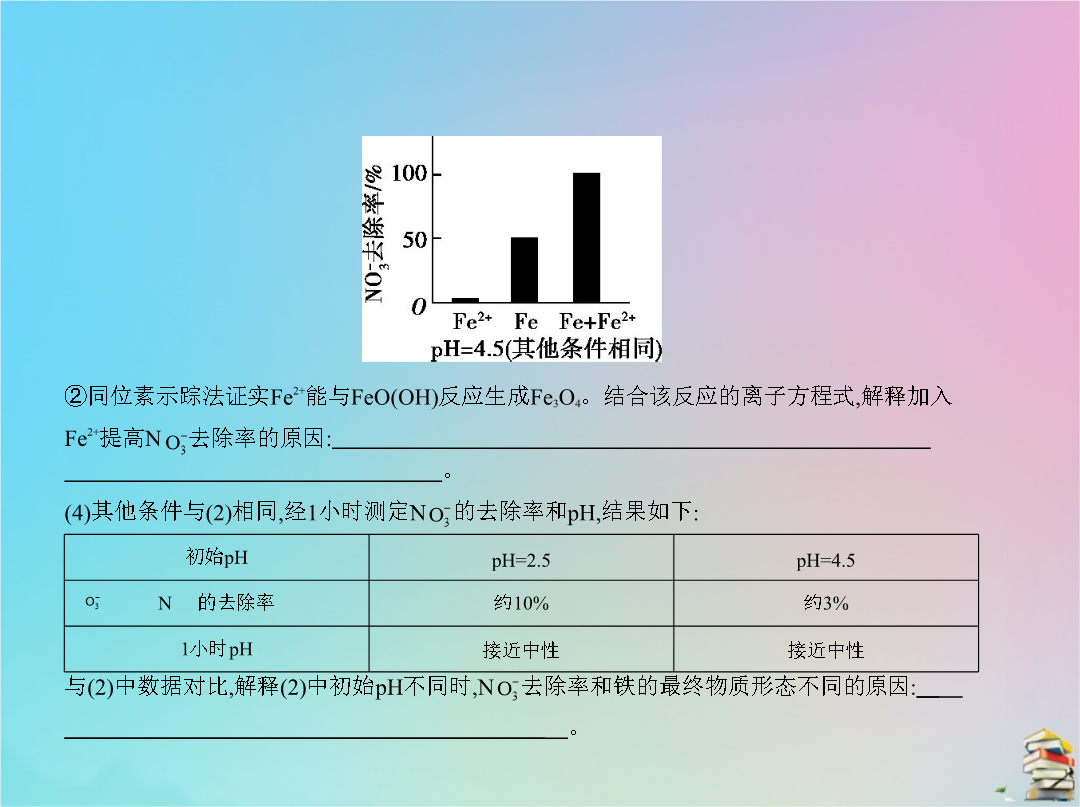
专题十六电化学五年高考2.(2012北京理综126分)人工光合作用能够借助太阳能用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图下列说法不正确的是 () A.该过程是将太阳能转化为化学能的过程B.催化剂a表面发生氧化反应有O2产生C.催化剂a附近酸性减弱催化剂b附近酸性增强D.催化剂b表面的反应是CO2+2H++2e- HCOOH3.(2011北京理综86分)结合下图判断下列叙述正确的是 ()4.(2016北京理综2613分)用零价铁(Fe)去除水体中的硝酸盐(N

(天津专用)高考化学一轮复习 专题十三 电化学课件-人教版高三全册化学课件.pptx
专题十三电化学A组自主命题·天津卷题组C.充电时b电极每增重0.65g溶液中有0.02molI-被氧化D.充电时a电极接外电源负极2.(2015天津理综46分)锌铜原电池装置如图所示其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是() A.铜电极上发生氧化反应B.电池工作一段时间后甲池的c(S )减小C.电池工作一段时间后乙池溶液的总质量增加D.阴阳离子分别通过交换膜向负极和正极移动保持溶液中电荷平衡3.(2016天津理综36分)下列叙述正确的是 ()A.使用催化剂能够降低

(山东专用)高考化学一轮复习 专题十三 电化学课件-人教版高三全册化学课件.pptx
专题十三电化学五年高考A.相比现有工业合成氨该方法条件温和同时还可提供电能B.阴极区在氢化酶作用下发生反应H2+2MV2+ 2H++2MV+C.正极区固氮酶为催化剂N2发生还原反应生成NH32.(2017课标Ⅰ116分)支撑海港码头基础的钢管桩常用外加电流的阴极保护法进行防腐工作原理如图所示其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 ()答案C将被保护的金属(钢管桩)与电源的负极相连防止钢管桩被腐蚀外加保护电流可以抑制金属电化学腐蚀产生的电流故其表面腐蚀电流接近于零A项正确;高硅

(山东专用)高考化学一轮复习 专题十三 电化学课件-人教版高三全册化学课件.pptx
专题十三电化学五年高考A.相比现有工业合成氨该方法条件温和同时还可提供电能B.阴极区在氢化酶作用下发生反应H2+2MV2+ 2H++2MV+C.正极区固氮酶为催化剂N2发生还原反应生成NH32.(2017课标Ⅰ116分)支撑海港码头基础的钢管桩常用外加电流的阴极保护法进行防腐工作原理如图所示其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 ()答案C将被保护的金属(钢管桩)与电源的负极相连防止钢管桩被腐蚀外加保护电流可以抑制金属电化学腐蚀产生的电流故其表面腐蚀电流接近于零A项正确;高硅

(山东专用)高考化学一轮复习 专题十三 电化学课件-人教版高三全册化学课件精编.pptx
专题十三电化学五年高考A.相比现有工业合成氨,该方法条件温和,同时还可提供电能B.阴极区,在氢化酶作用下发生反应H2+2MV2+ 2H++2MV+C.正极区,固氮酶为催化剂,N2发生还原反应生成NH32.(2017课标Ⅰ,11,6分)支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 ()答案C将被保护的金属(钢管桩)与电源的负极相连,防止钢管桩被腐蚀,外加保护电流可以抑制金属电化学腐蚀产生的电流,故其表面腐蚀电流接近于零,A项
