
高考化学一轮复习 第35讲 晶体结构与性质课件-人教版高三全册化学课件.ppt

一条****然后






亲,该文档总共66页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

高考化学一轮复习 第35讲 晶体结构与性质课件-人教版高三全册化学课件.ppt
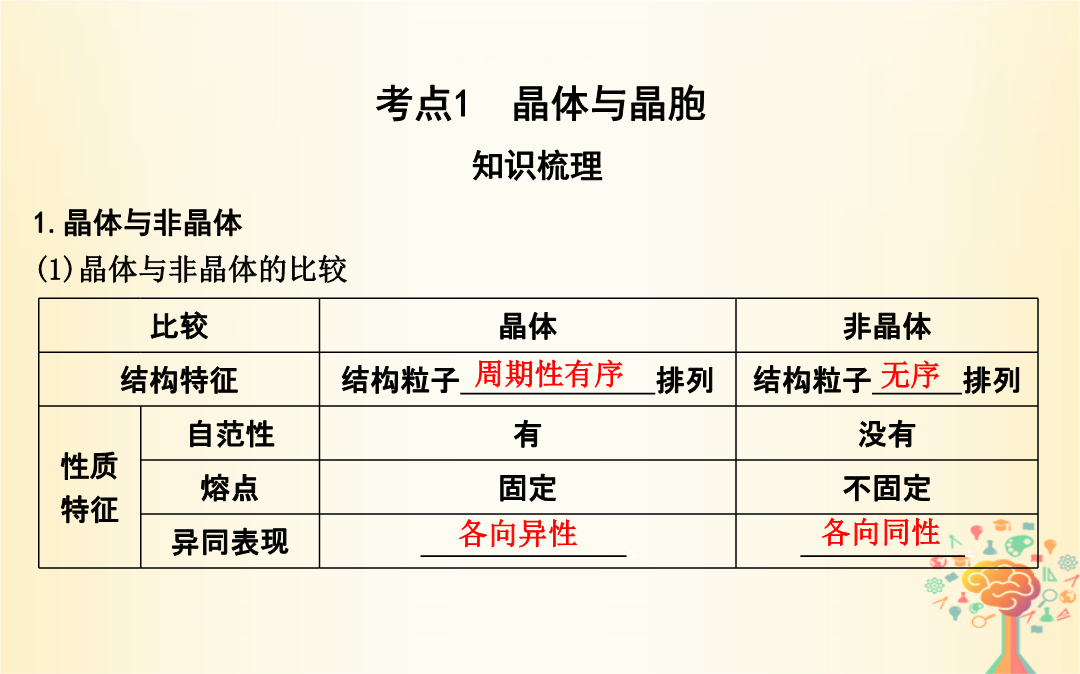
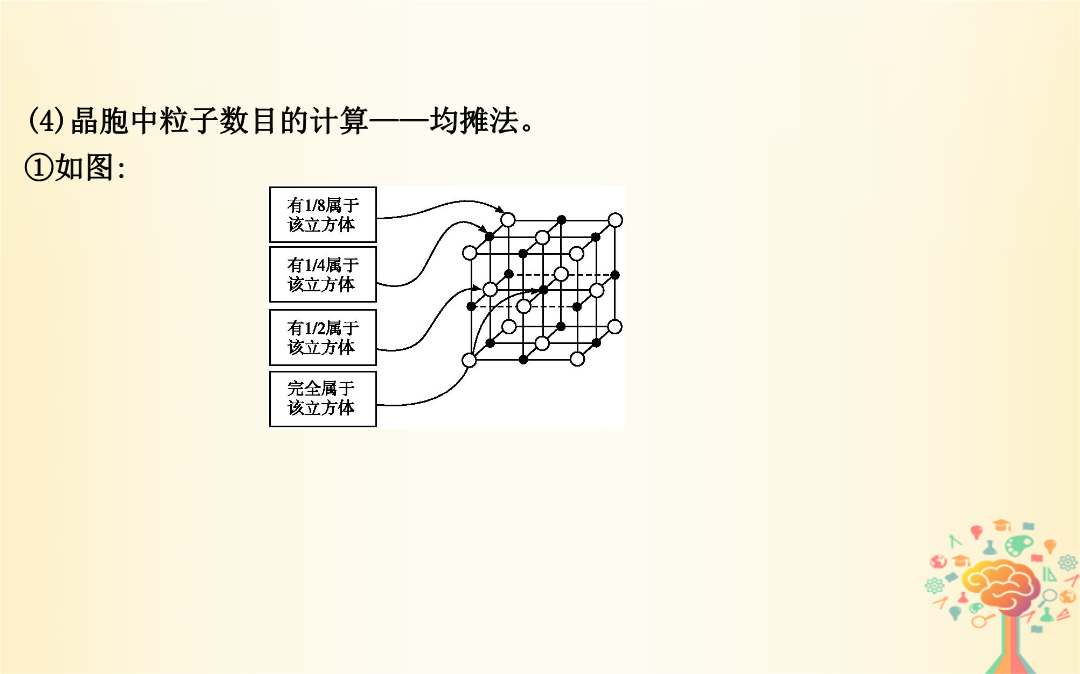
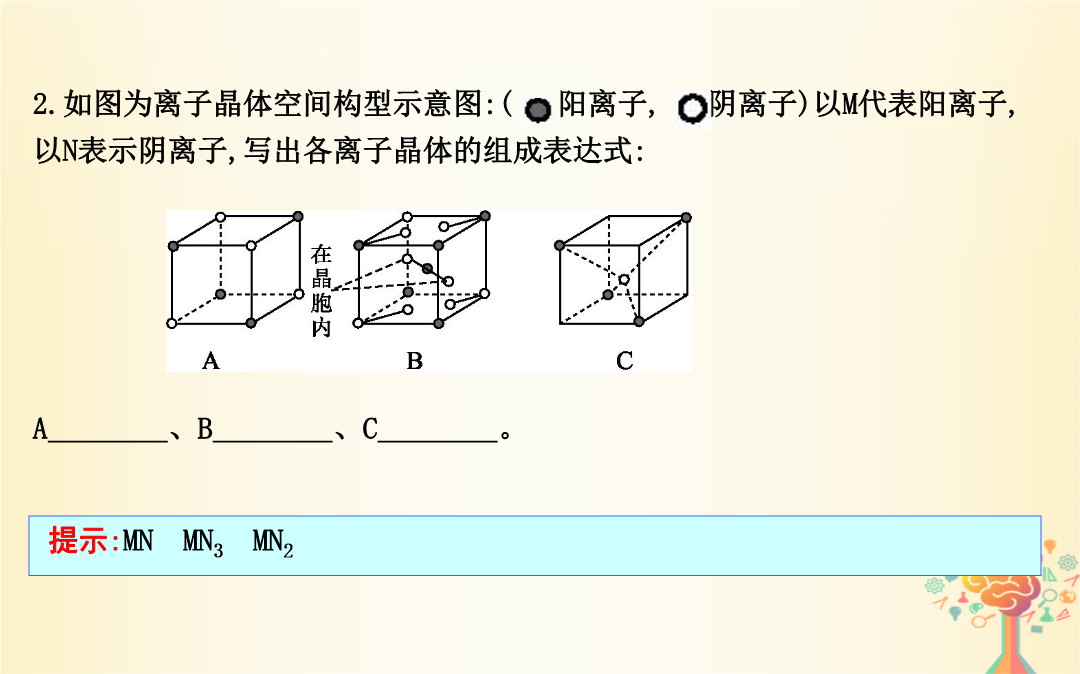
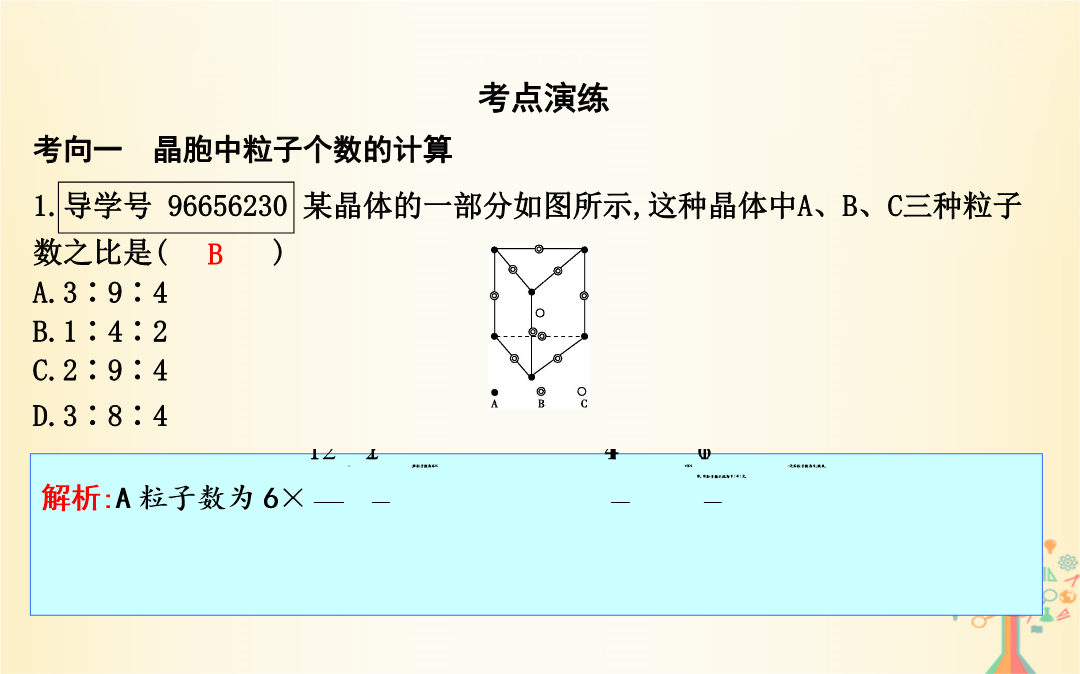
第35讲晶体结构与性质【考纲要求】1.了解原子晶体的特征能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。2.了解分子晶体结构与性质的关系。3.了解晶体的类型了解不同类型晶体中结构微粒、微粒间作用力的区别。4.理解金属键的含义能用金属键理论解释金属的一些物理性质。了解金属晶体常见的堆积方式。5.理解离子键的形成能根据离子化合物的结构特征解释其物理性质。6.了解晶胞的概念能根据晶胞确定晶体的组成并进行相关的计算。7.了解晶格能的概念了解晶格能对离子晶体性质的影响。考点1晶体与晶胞实例2.晶胞(1)

高考化学一轮复习 第35讲 晶体结构与性质课件-人教版高三全册化学课件.ppt
第35讲晶体结构与性质【考纲要求】1.了解原子晶体的特征能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。2.了解分子晶体结构与性质的关系。3.了解晶体的类型了解不同类型晶体中结构微粒、微粒间作用力的区别。4.理解金属键的含义能用金属键理论解释金属的一些物理性质。了解金属晶体常见的堆积方式。5.理解离子键的形成能根据离子化合物的结构特征解释其物理性质。6.了解晶胞的概念能根据晶胞确定晶体的组成并进行相关的计算。7.了解晶格能的概念了解晶格能对离子晶体性质的影响。考点1晶体与晶胞实例2.晶胞(1)

高考化学一轮复习 物质结构与性质 第35讲 晶体结构与性质课件-人教版高三全册化学课件.ppt
第35讲晶体结构与性质【考纲要求】1.了解原子晶体的特征能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。2.了解分子晶体结构与性质的关系。3.了解晶体的类型了解不同类型晶体中结构微粒、微粒间作用力的区别。4.理解金属键的含义能用金属键理论解释金属的一些物理性质。了解金属晶体常见的堆积方式。5.理解离子键的形成能根据离子化合物的结构特征解释其物理性质。6.了解晶胞的概念能根据晶胞确定晶体的组成并进行相关的计算。7.了解晶格能的概念了解晶格能对离子晶体性质的影响。考点突破考点突破

(京津鲁琼版)高考化学一轮复习 第35讲 晶体结构与性质课件-人教版高三全册化学课件.ppt
周期性有序有凝固(凝华)2NA4NA12468分子间作用力612分子范德华力很高kJ·mol-1原子晶体小高

(天津专用)高考化学一轮复习 第33讲 晶体结构与性质课件-人教版高三全册化学课件.pptx
第33讲晶体结构与性质-2--3--4--5--6--7--8--9--10--11--12--13--14--15--16--17--18--19--20--21--22--23--24--25--26--27--28--29--30--31--32--33--34--35--36--37--38--39--40--41--42--43--44--45--46-
