
高考化学一轮复习 物质结构与性质 第35讲 晶体结构与性质课件-人教版高三全册化学课件.ppt

猫巷****志敏








亲,该文档总共74页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

高考化学一轮复习 物质结构与性质 第35讲 晶体结构与性质课件-人教版高三全册化学课件.ppt
第35讲晶体结构与性质【考纲要求】1.了解原子晶体的特征能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。2.了解分子晶体结构与性质的关系。3.了解晶体的类型了解不同类型晶体中结构微粒、微粒间作用力的区别。4.理解金属键的含义能用金属键理论解释金属的一些物理性质。了解金属晶体常见的堆积方式。5.理解离子键的形成能根据离子化合物的结构特征解释其物理性质。6.了解晶胞的概念能根据晶胞确定晶体的组成并进行相关的计算。7.了解晶格能的概念了解晶格能对离子晶体性质的影响。考点突破考点突破

高考化学一轮复习 第35讲 晶体结构与性质课件-人教版高三全册化学课件.ppt
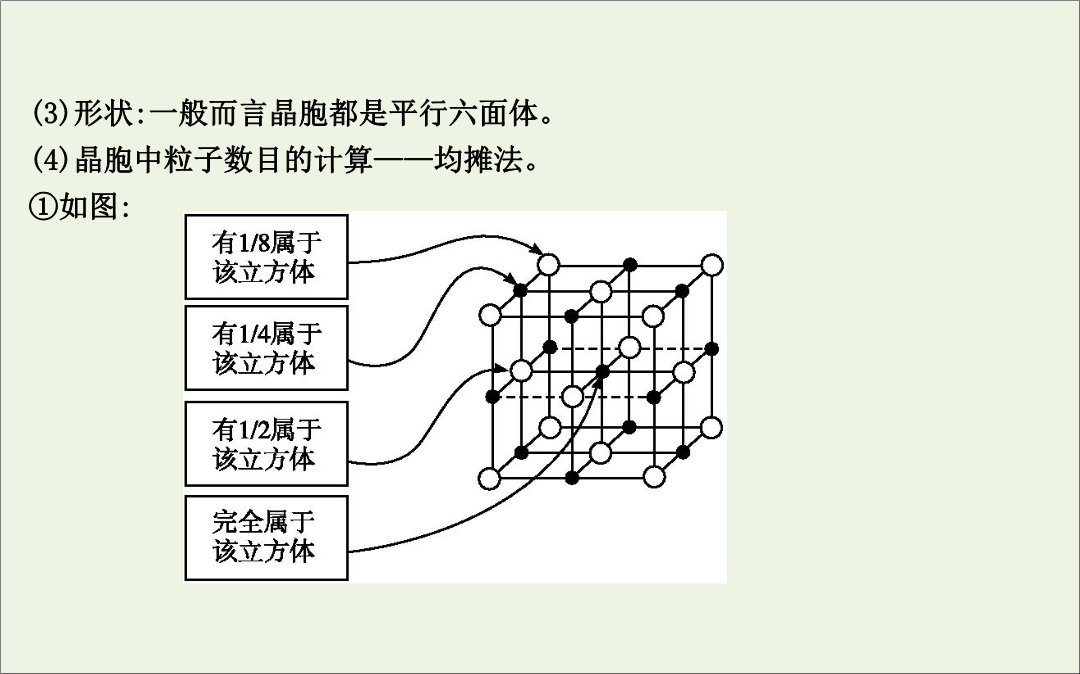
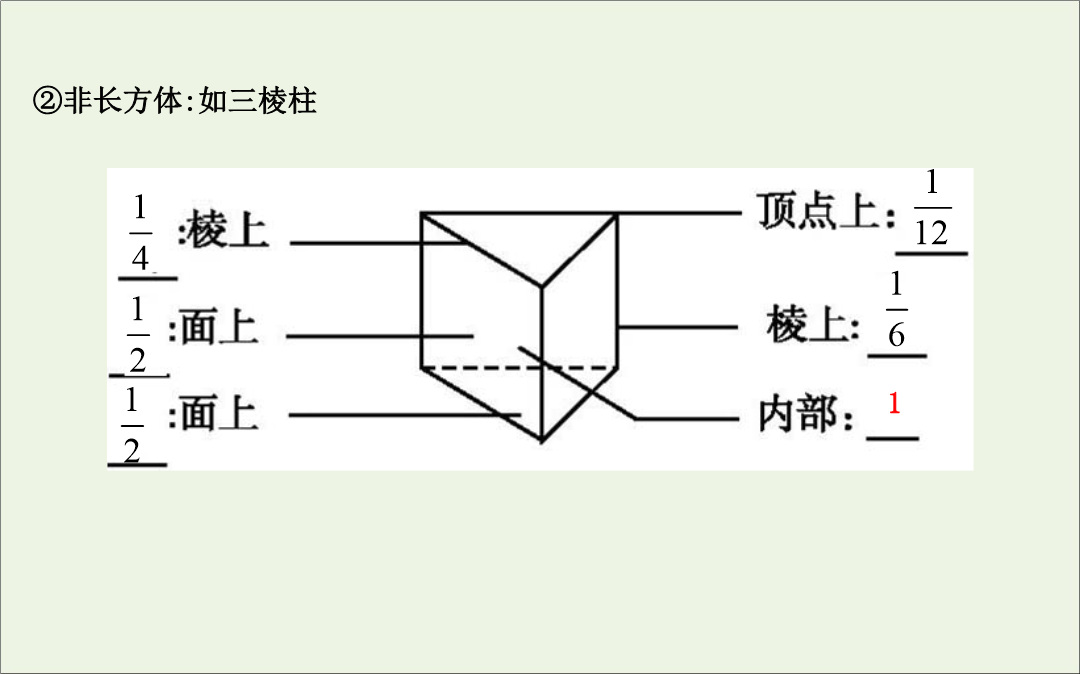
第35讲晶体结构与性质【考纲要求】1.了解原子晶体的特征能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。2.了解分子晶体结构与性质的关系。3.了解晶体的类型了解不同类型晶体中结构微粒、微粒间作用力的区别。4.理解金属键的含义能用金属键理论解释金属的一些物理性质。了解金属晶体常见的堆积方式。5.理解离子键的形成能根据离子化合物的结构特征解释其物理性质。6.了解晶胞的概念能根据晶胞确定晶体的组成并进行相关的计算。7.了解晶格能的概念了解晶格能对离子晶体性质的影响。考点1晶体与晶胞实例2.晶胞(1)

高考化学一轮复习 第35讲 晶体结构与性质课件-人教版高三全册化学课件.ppt
第35讲晶体结构与性质【考纲要求】1.了解原子晶体的特征能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。2.了解分子晶体结构与性质的关系。3.了解晶体的类型了解不同类型晶体中结构微粒、微粒间作用力的区别。4.理解金属键的含义能用金属键理论解释金属的一些物理性质。了解金属晶体常见的堆积方式。5.理解离子键的形成能根据离子化合物的结构特征解释其物理性质。6.了解晶胞的概念能根据晶胞确定晶体的组成并进行相关的计算。7.了解晶格能的概念了解晶格能对离子晶体性质的影响。考点1晶体与晶胞实例2.晶胞(1)

高考化学一轮复习 第12章 物质结构与性质 第37讲 晶体结构与性质课件 新人教版-新人教版高三全册化学课件.ppt
周期性有序熔点基本单元分子较小多××答案答案考点一四类晶体的组成和性质解析答案答案考点二常见晶体模型与晶胞计算解析解析解析答案答案答案解析解析答案答案答案解析答案解析答案解析答案答案解析答案解析答案解析解析解析答案解析解析答案解析解析

高考化学一轮复习 第12章 物质结构与性质 第37讲 晶体结构与性质课件 新人教版-新人教版高三全册化学课件.ppt
周期性有序熔点基本单元分子较小多××答案答案考点一四类晶体的组成和性质解析答案答案考点二常见晶体模型与晶胞计算解析解析解析答案答案答案解析解析答案答案答案解析答案解析答案解析答案答案解析答案解析答案解析解析解析答案解析解析答案解析解析
