
高考化学总复习 原电池和化学电源知识讲解-人教版高三全册化学试题.doc

是你****盟主









亲,该文档总共15页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

高考化学总复习 原电池和化学电源知识讲解-人教版高三全册化学试题.doc
高考总复习原电池和化学电源【考纲要求】1.了解原电池的工作原理。2.能写出原电池的电极反应式和反应的总方程式。3.能根据氧化还原反应方程式设计简单的原电池。4.能根据原电池原理进行简单计算。5.熟悉常见的化学电源(一次电池、二次电池和燃料电池)能分析常见化学电池工作原理了解废旧电池回收的意义。【考点梳理】考点一、原电池的概念1.能量的转化原电池:将化学能转变为电能的装置。电能是现代社会应用最广泛、使用最方便、污染最小的一种二次能源又称电力。2.工作原理设计一种装置使氧化还原反应所释放的能量直接

高考化学总复习 配餐作业19 原电池 化学电源-人教版高三全册化学试题.doc
原电池化学电源A组·全员必做题1.各式各样电池的迅速发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是()A.手机上用的锂离子电池属于一次电池B.锌锰干电池中锌电极是负极C.氢氧燃料电池工作时氢气在负极上被还原D.太阳能电池的主要材料是高纯度的二氧化硅解析:手机上的电池可以充电属于二次电池;锌锰干电池中锌失去电子生成Zn2+故作为负极;氢氧燃料电池工作时氢气在负极被氧化;太阳能电池的主要材料为硅。故A、C、D项错误B项正确。答案:B2.如图在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y外电路

优化探究高考化学总复习 6.2原电池 化学电源课时作业-人教版高三全册化学试题.doc
课时作业(二十四)原电池化学电源一、选择题1.各式各样电池的迅速发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是()A.手机上用的锂离子电池属于一次电池B.锌锰干电池中锌电极是负极C.氢氧燃料电池工作时氢气在负极被还原D.太阳能电池的主要材料为二氧化硅答案:B2.如图在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y外电路中电子流向如图所示关于该装置的下列说法正确的是()A.外电路的电流方向为X→外电路→YB.若两电极分别为铁和碳棒则X为碳棒Y为铁C.X极上发生的是还原反应Y极上发生的是

高考化学一轮复习 专题6.2 原电池 化学电源(知识讲解)(含解析)-人教版高三全册化学试题.doc
第二讲原电池化学电源【真题速递】1.(2019.全国Ⅲ卷)为提升电池循环效率和稳定性科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点设计了采用强碱性电解质的3D−Zn—NiOOH二次电池结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)ZnO(s)+2Ni(OH)2(s)。A.三维多孔海绵状Zn具有较高的表面积所沉积的ZnO分散度高B.充电时阳极反应为Ni(OH)2(s)+OH−(aq)−e−NiOOH(s)+H2O(l)C.放电时负极反应为Zn(s)+
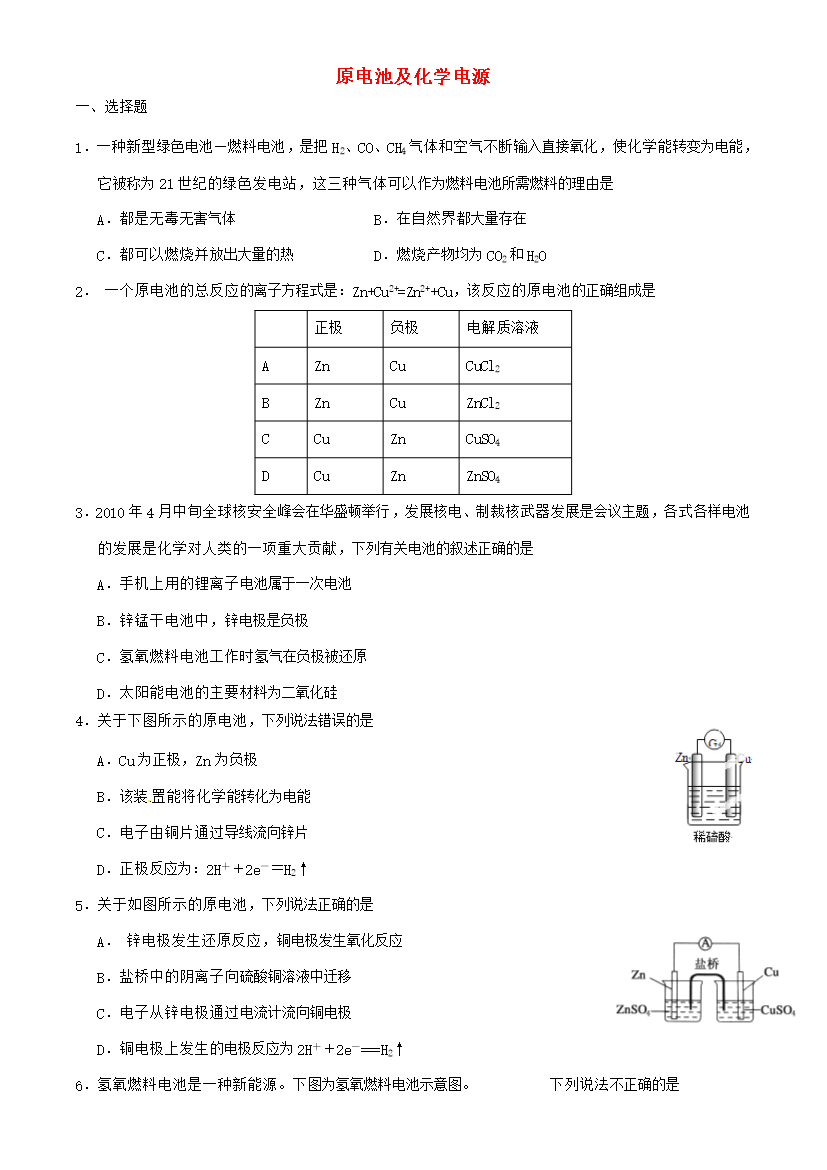
高考化学一轮复习 原电池及化学电源练习-人教版高三全册化学试题.doc
原电池及化学电源选择题1.一种新型绿色电池—燃料电池是把H2、CO、CH4气体和空气不断输入直接氧化使化学能转变为电能它被称为21世纪的绿色发电站这三种气体可以作为燃料电池所需燃料的理由是A.都是无毒无害气体B.在自然界都大量存在C.都可以燃烧并放出大量的热D.燃烧产物均为CO2和H2O2.一个原电池的总反应的离子方程式是:Zn+Cu2+=Zn2++Cu该反应的原电池的正确组成是正极负极电解质溶液AZnCuCuCl2BZnCuZnCl2CCu
