
2013高考化学 考前回归 知识点整理 第一单元 走进化学工业 新人教版选修2.doc

景福****90







亲,该文档总共13页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

2013高考化学 考前回归 知识点整理 第一单元 走进化学工业 新人教版选修2.doc
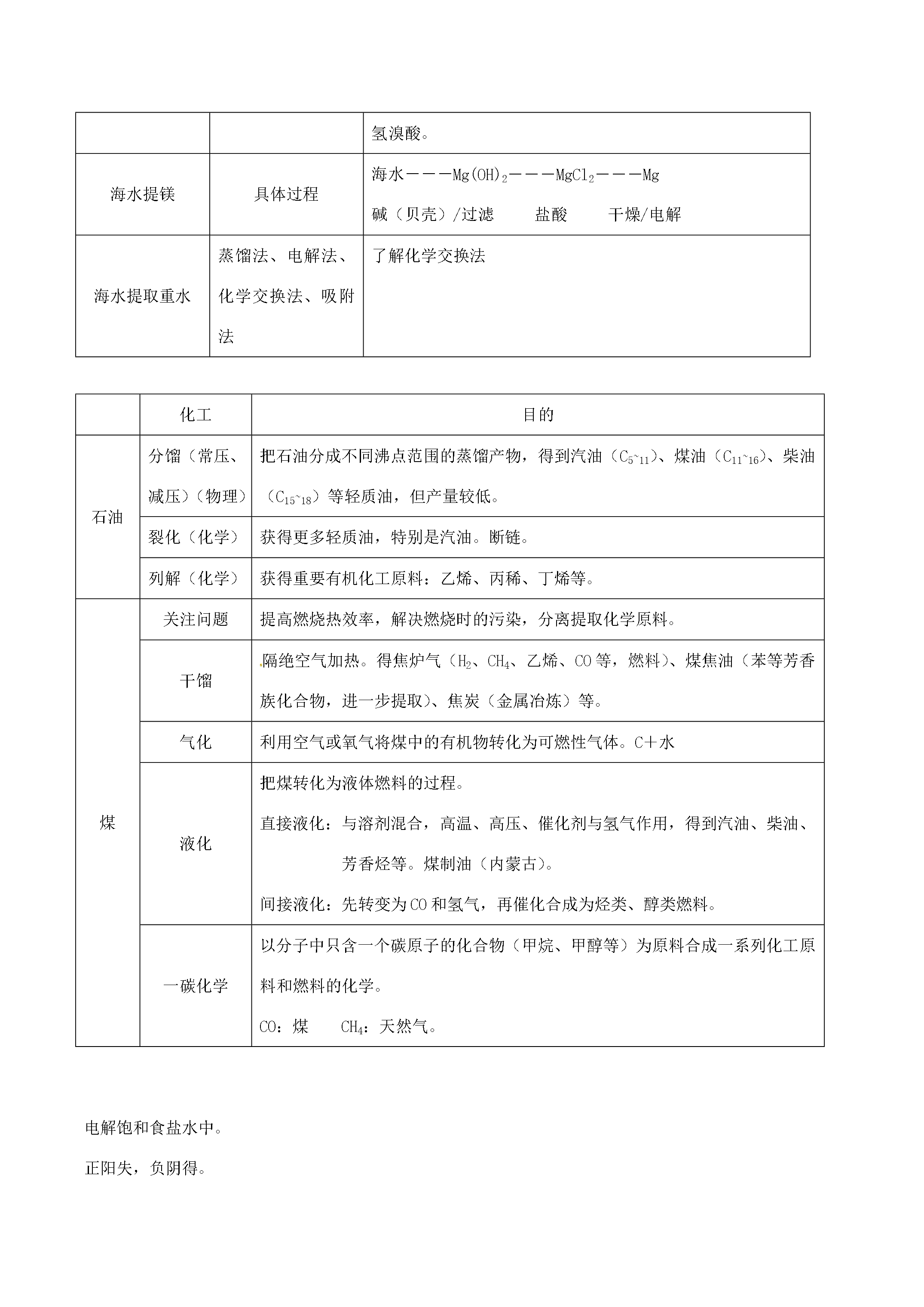
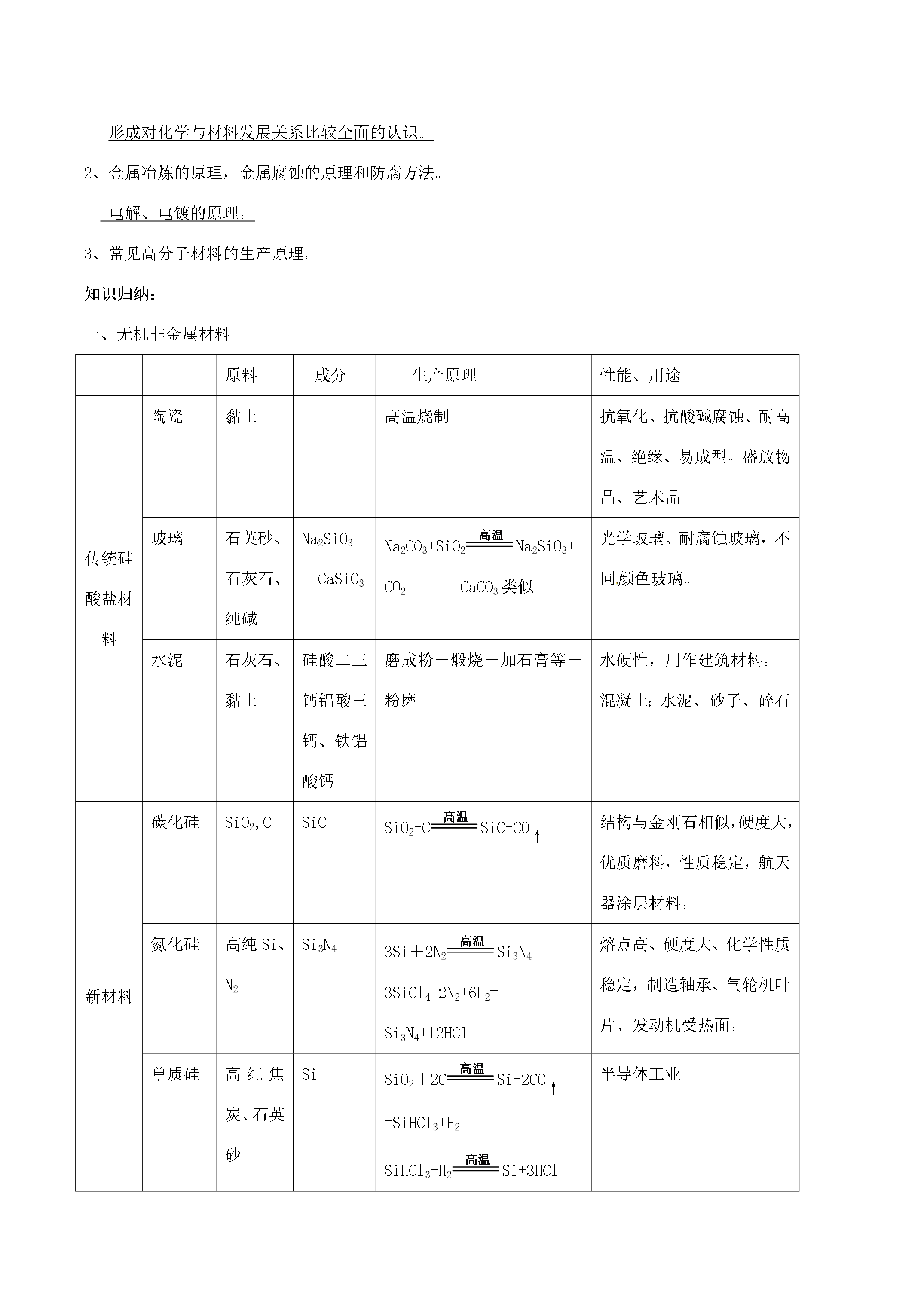
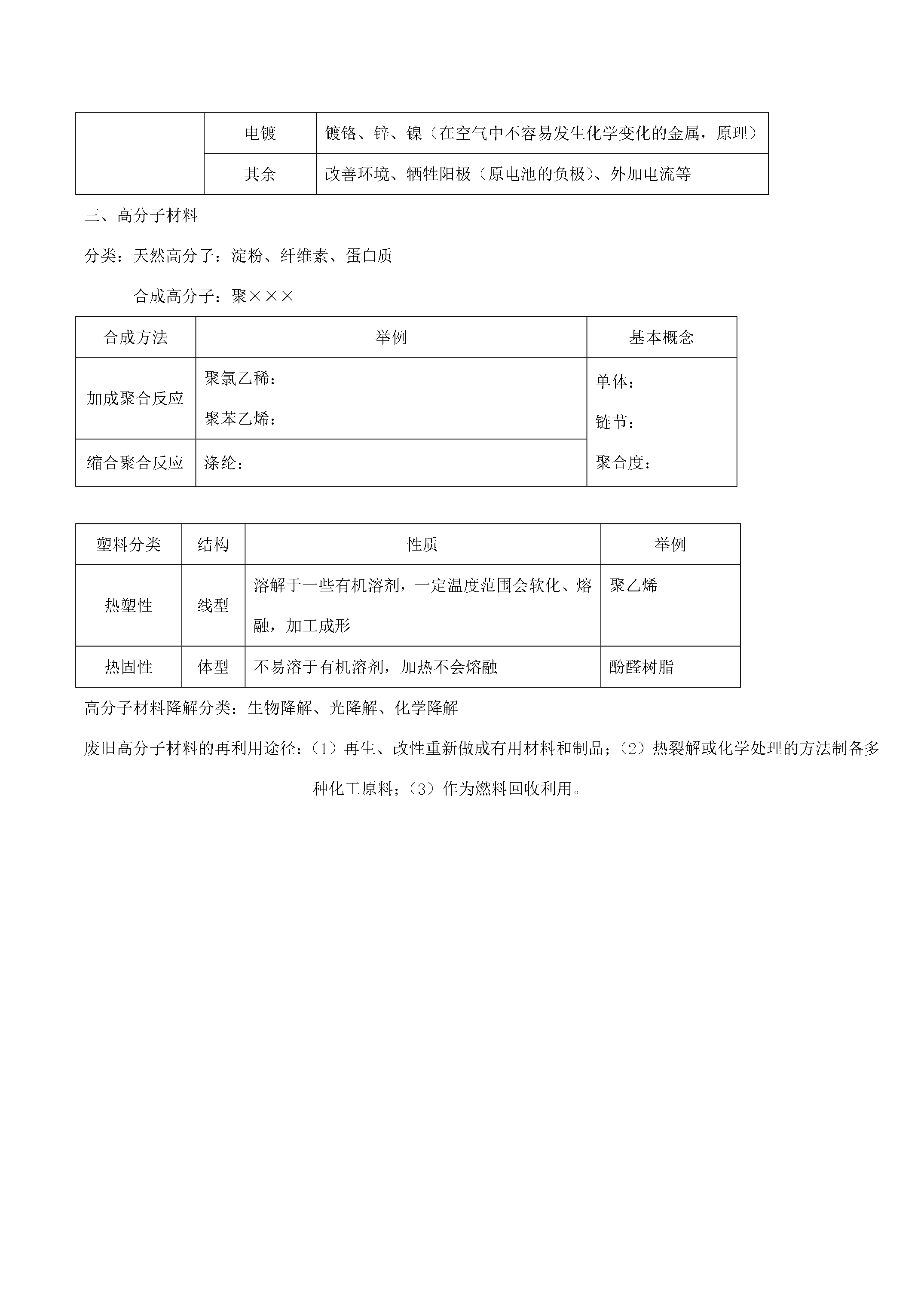
11化学选修2《化学与技术》第一单元走进化学工业教学重点(难点):1、化工生产过程中的基本问题。2、工业制硫酸的生产原理。平衡移动原理及其对化工生产中条件控制的意义和作用。3、合成氨的反应原理。合成氨生产的适宜条件。4、氨碱法的生产原理。复杂盐溶液中固体物质的结晶、分离和提纯。知识归纳:1制硫酸反应原理造气:S+O2==SO2(条件加热)催化氧化:2SO2+O22SO3吸收:SO3+H2O==H2SO498.3%的硫酸吸收。原料选择黄铁矿:FeS2硫磺:S反应条件2SO2+O22S

2013高考化学 考前回归 知识点整理 第一单元 走进化学工业 新人教版选修2.doc
化学选修2《化学与技术》第一单元走进化学工业教学重点(难点):1、化工生产过程中的基本问题。2、工业制硫酸的生产原理。平衡移动原理及其对化工生产中条件控制的意义和作用。3、合成氨的反应原理。合成氨生产的适宜条件。4、氨碱法的生产原理。复杂盐溶液中固体物质的结晶、分离和提纯。知识归纳:1制硫酸反应原理造气:S+O2==SO2(条件加热)催化氧化:2SO2+O22SO3吸收:SO3+H2O==H2SO498.3%的硫酸吸收。原料选择黄铁矿:FeS2硫磺:S反应条件2SO2+O22SO3

2013高考化学 考前回归 知识点整理 第一单元 走进化学工业 新人教版选修2.doc
化学选修2《化学与技术》第一单元走进化学工业教学重点(难点):1、化工生产过程中的基本问题。2、工业制硫酸的生产原理。平衡移动原理及其对化工生产中条件控制的意义和作用。3、合成氨的反应原理。合成氨生产的适宜条件。4、氨碱法的生产原理。复杂盐溶液中固体物质的结晶、分离和提纯。知识归纳:1制硫酸反应原理造气:S+O2==SO2(条件加热)催化氧化:2SO2+O22SO3吸收:SO3+H2O==H2SO498.3%的硫酸吸收。原料选择黄铁矿:FeS2硫磺:S反应条件2SO2+O22SO3放热可逆反应(低温、高压

2013高考化学 考前回归 知识点整理 第一单元 走进化学工业 新人教版选修2.doc
化学选修2《化学与技术》第一单元走进化学工业教学重点(难点):1、化工生产过程中的基本问题。2、工业制硫酸的生产原理。平衡移动原理及其对化工生产中条件控制的意义和作用。3、合成氨的反应原理。合成氨生产的适宜条件。4、氨碱法的生产原理。复杂盐溶液中固体物质的结晶、分离和提纯。知识归纳:1制硫酸反应原理造气:S+O2==SO2(条件加热)催化氧化:2SO2+O22SO3吸收:SO3+H2O==H2SO498.3%的硫酸吸收。原料选择黄铁矿:FeS2硫磺:S反应条件2SO2+O22SO3放热可逆反应(低温、高压

2013高考化学 考前回归 知识点整理 新人教版选修5.doc
选修5有机化学基础知识点整理一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的下同)醇、醛、羧酸等。(2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。(它们都能与水形成氢键)。(3)具有特殊溶解性的:①乙醇是一种很好的溶剂既能溶解许多无机物又能溶解许多有机物所以常用乙醇来溶解植物色素或其中的药用成分也常用乙醇作为反应的溶剂使参加反应的有机物和无机物均能溶解增大接触
