
物理化学绪论专题省名师优质课赛课获奖课件市赛课一等奖课件.ppt

天天****心情







亲,该文档总共102页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

物理化学绪论专题省名师优质课赛课获奖课件市赛课一等奖课件.ppt
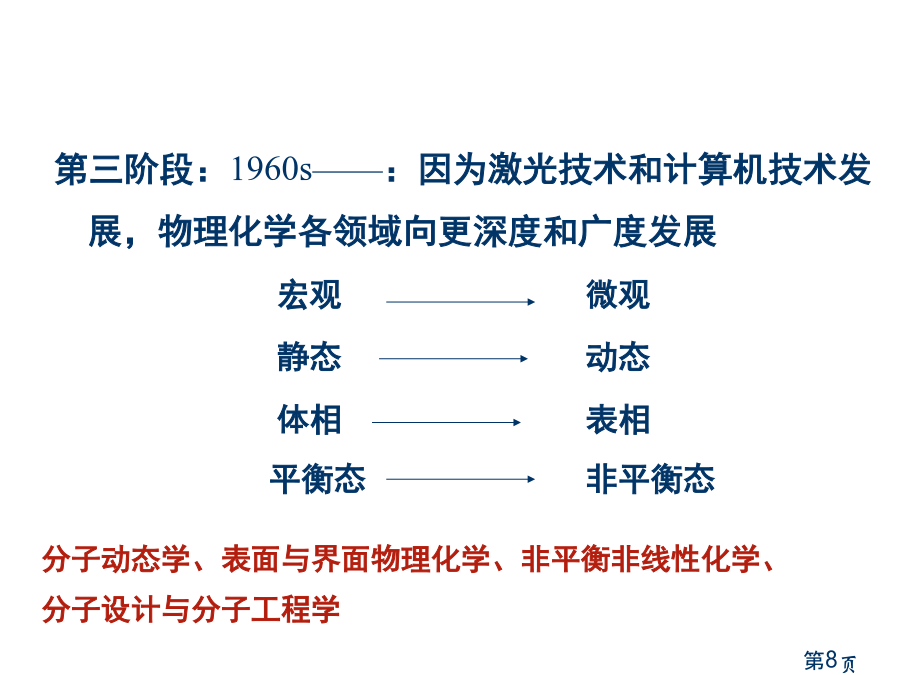
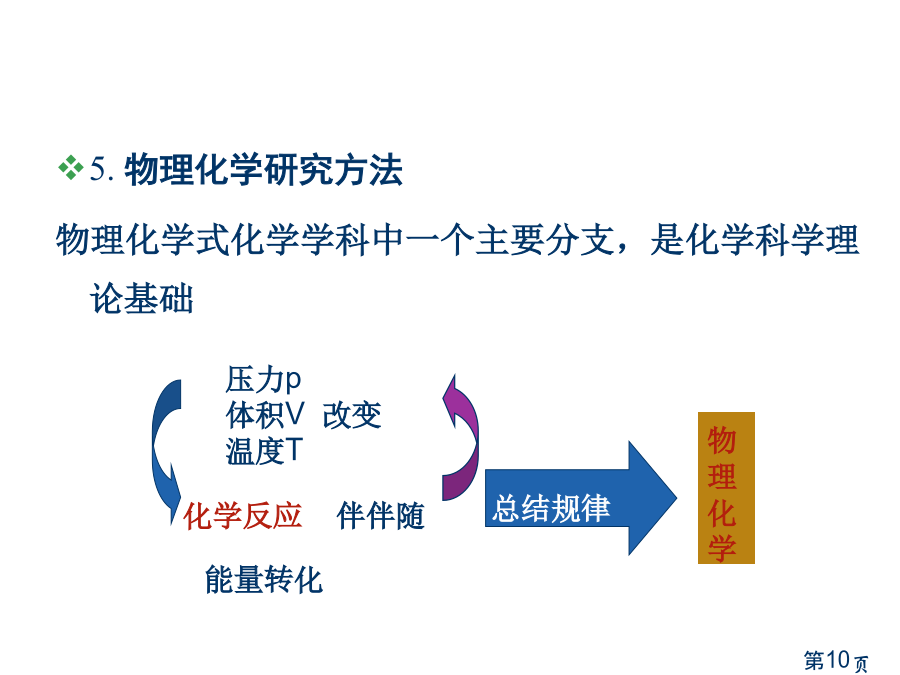
物理化学简明教程Contents一、绪论2.物理化学研究内容一、绪论3.物理化学建立与发展第一阶段:1887——1920:化学平衡和化学反应速率唯象规律建立19世纪中叶:热力学第一定律和热力学第二定律提出1850:Wilhelmy第一次定量测定反应速率1879:质量作用定律建立1889:德文“物理化学”杂志创刊1906——1912:Nernst热定律和热力学第三定律建立第二阶段:1920s——1960s:结构化学和量子化学蓬勃发展和化学改变规律微观探索1926:量子力学建立1927:求解氢分子薛定谔方程1

大学物理绪论省名师优质课赛课获奖课件市赛课一等奖课件.ppt
绪论一、物理学研究对象与研究方法物理学研究运动:当前观察所及宇宙2、物理学研究方法(3)科学发觉中创造性思维方法二、物理学课程地位与作用三、物理学在科学技术中应用人类社会发展与物理学进步有亲密关系:电磁学研究和电磁理论(法拉第、麦克斯韦)建立:工业电气化和当代化无线电通信。人类社会发展与物理学进步有亲密关系:20世纪以来以相对论和量子力学(爱因斯坦等物理学家创建)巨大进展:开辟了近代科学新纪元,开创了电子学、半导体、等离子体、激光、量子化学、生物工程、航天工程等新技术领域。微型计算机、激光光通信、核能、纳

语法填空专题专题省名师优质课赛课获奖课件市赛课一等奖课件.ppt
RationalclozeFewpeopleIknowseemtohavemuchdesireortimetocook.MakingChinese56(dish)isseenasespeciallytroublesome.Manywesterners57cometoChinacookmuchlessthanintheirowncountriesoncetheyrealizehowcheap58canbetoeatout.Istillremember59(visit)afriendwho’dlivedher

高一物理绪论-LI省名师优质课赛课获奖课件市赛课一等奖课件.ppt
判天地之美埃及金字塔过山车火箭升空流星雨闪电磁悬浮列车彩虹量子围栏太阳系3/654/655/656/657/658/659/6510/6511/651)时间尺度2)空间尺度物理学与自然规律静电现象物理学规律物理学科与其它学科联络区分物理学更关心瀑布基本运动规律。自然界和自然规律隐藏在黑暗中:上帝说,让牛顿出生吧!于是一切都是光明。古希腊人探索:地球位于宇宙中心地面附近物质是由土、水、气、火四种元素组成。公元100年后,天文学家托勒密完善了地心说。地心说观点一直连续了近两千年。16世纪中叶,天文学家哥白尼在

高考专题:转换省名师优质课赛课获奖课件市赛课一等奖课件.ppt
语言文字应用年份考情分析图文转换五大类型大致上描述或表示物体形状、相对大小、物体与物体之间联络(关系),描述某器材或某机械大致结构和工作基本原理,描述某个工艺过程简单图示都叫作示意图或框架图。框架图(示意图)特点是简单明了,它突出了重点,忽略很屡次要细节。解析:本题考查图文转换能力。这个构思框架中心是“‘中华文化体验’计划”,内容包含讲座和活动两部分,其中,活动部分又包含两方面。答题时要把握好表述角度、对象,合理确定表述次序,语言简练。【知识精讲】把握框架图(示意图)层次特征解答框架图(示意图)类图文转换
