
高中化学 《硫酸、硝酸和氨》课件 新人教必修1.ppt

仙人****88







亲,该文档总共62页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

高中化学 《硫酸、硝酸和氨》课件 新人教必修1.ppt
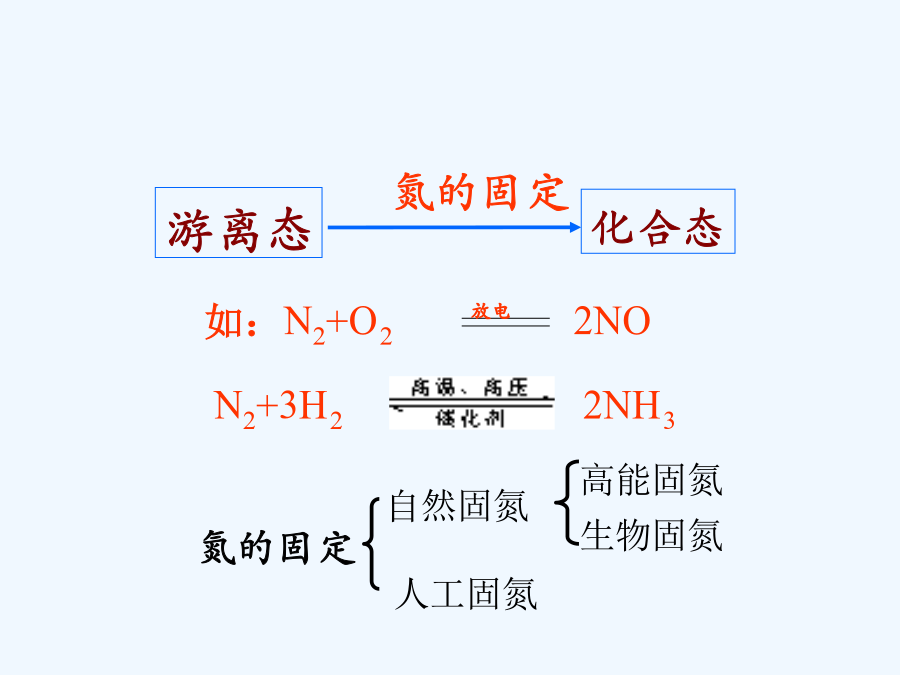
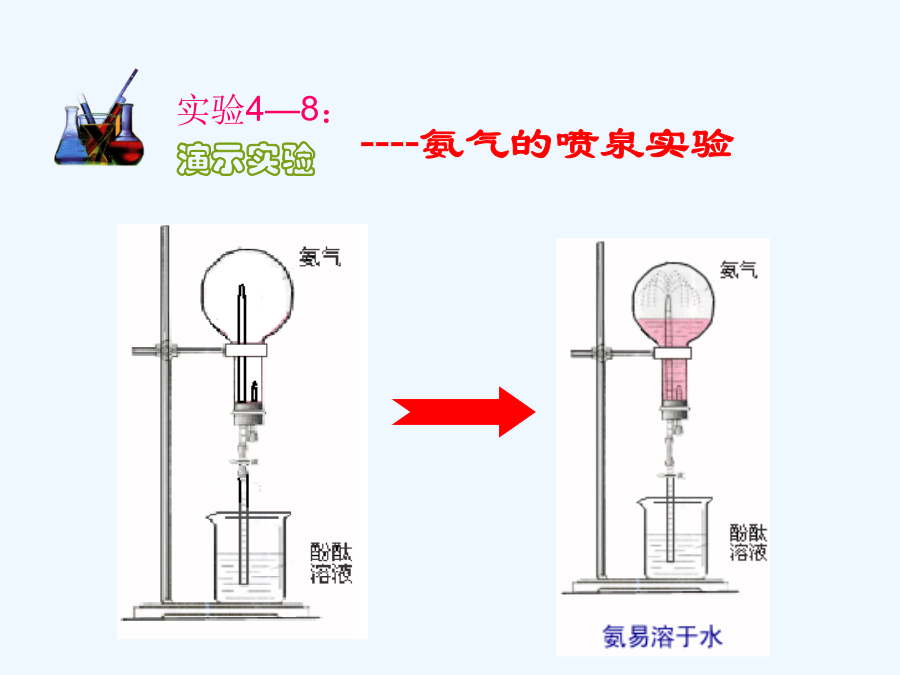
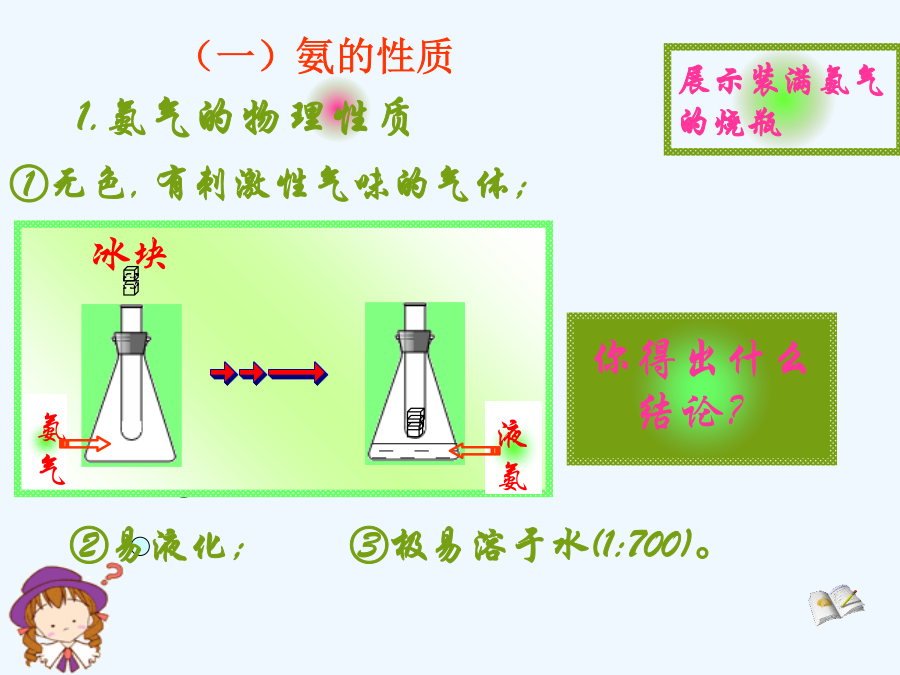
新课标人教版课件系列第四章非金属及其化合物教学目标目录一、氨游离态【思考】----氨气的喷泉实验城市中常见的人造喷泉及火山爆发的原理与上述的原理相似。(2)溶液为什么变为红色?2、氨的化学性质①NH3极易溶于水。(1:700)氨水中的分子有:H2O、NH3和NH3·H2O(2)氨跟酸的反应不能这个反应叫做氨的催化氧化它是工业上制硝酸的基础.(1)氮肥铵盐铵盐的化学性质(2)铵盐与碱反应铵盐的用途种类氯化铵的妙用这两种气体把棉布与空气隔

高中化学 《硫酸、硝酸和氨》课件 新人教必修1.ppt
第四章非金属及其化合物教学目标目录一、氨游离态【思考】----氨气的喷泉实验城市中常见的人造喷泉及火山爆发的原理与上述的原理相似。(2)溶液为什么变为红色?2、氨的化学性质①NH3极易溶于水。(1:700),氨水中的分子有:H2O、NH3和NH3·H2O(2)氨跟酸的反应不能这个反应叫做氨的催化氧化,它是工业上制硝酸的基础.(1)氮肥铵盐铵盐的化学性质(2)铵盐与碱反应铵盐的用途种类氯化铵的妙用这两种气体把棉布与空气隔绝起来,棉布在没有氧气的条件下当然就不能燃烧了。当这两种气体保护棉布不被火烧的同时,它们

高中化学硫酸、硝酸和氨课件新人教必修一.ppt
硫酸、硝酸和氨现象:现象:现象:分析现象:现象:总结硫酸用途释疑:稀硫酸的氧化性和浓硫酸的氧化性有何不同?大多数金属(Pt、Au除外)都能被硝酸氧化不活泼金属与硝酸反应硝酸被还原为NO2或NO活泼金属与硝酸反应硝酸的还原产物很复杂。浓硫酸和硝酸的性质对比三、氨(Ammonia)1、氨的物理性质(2)氨与酸反应生成铵盐注意:氨能与多种酸反应生成铵盐。但只有与挥发性酸反应才有产生白烟的现象3、铵盐的性质4、氨气的实验室制法氨气的制备干燥剂的选择氨的用途

高中化学新人教必修1 硫酸 硝酸和氨(1).doc
硫酸、硝酸和氨教学目标1.知识与技能。(1)掌握浓硫酸、硝酸的性质;了解氨的物理性质掌握氨的化学性质;了解铵盐的性质。(2)了解硫酸、硝酸的用途。2.过程与方法。通过学生分组讨论、实验探究培养学生分析问题、解决问题能力、实验操作的能力。3.情感态度与价值观。(1)使学生体会化学对环保的重要意义培养学生关注社会的意识和责任感。(2)通过对问题的讨论、实验的探究培养学生积极思考、勇于探究的精神。二、教学重点与难点重点:浓硫酸、硝酸的氧化性氨的化学性质。难点:浓硫酸、硝酸的氧化性。三、教材分析硫酸、硝酸是硫、氮

高中化学新人教必修1 硫酸 硝酸和氨(1).doc
硫酸、硝酸和氨教学目标1.知识与技能。(1)掌握浓硫酸、硝酸的性质;了解氨的物理性质,掌握氨的化学性质;了解铵盐的性质。(2)了解硫酸、硝酸的用途。2.过程与方法。通过学生分组讨论、实验探究,培养学生分析问题、解决问题能力、实验操作的能力。3.情感态度与价值观。(1)使学生体会化学对环保的重要意义,培养学生关注社会的意识和责任感。(2)通过对问题的讨论、实验的探究,培养学生积极思考、勇于探究的精神。二、教学重点与难点重点:浓硫酸、硝酸的氧化性,氨的化学性质。难点:浓硫酸、硝酸的氧化性。三、教材分析硫酸、硝
