
(通用版)高考化学二轮复习 题型二 无机综合——化工流程综合题的研究大题突破课件-人教版高三全册化学课件.pptx

Ja****20





亲,该文档总共46页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料
(通用版)高考化学二轮复习 题型二 无机综合——化工流程综合题的研究大题突破课件-人教版高三全册化学课件.pptx
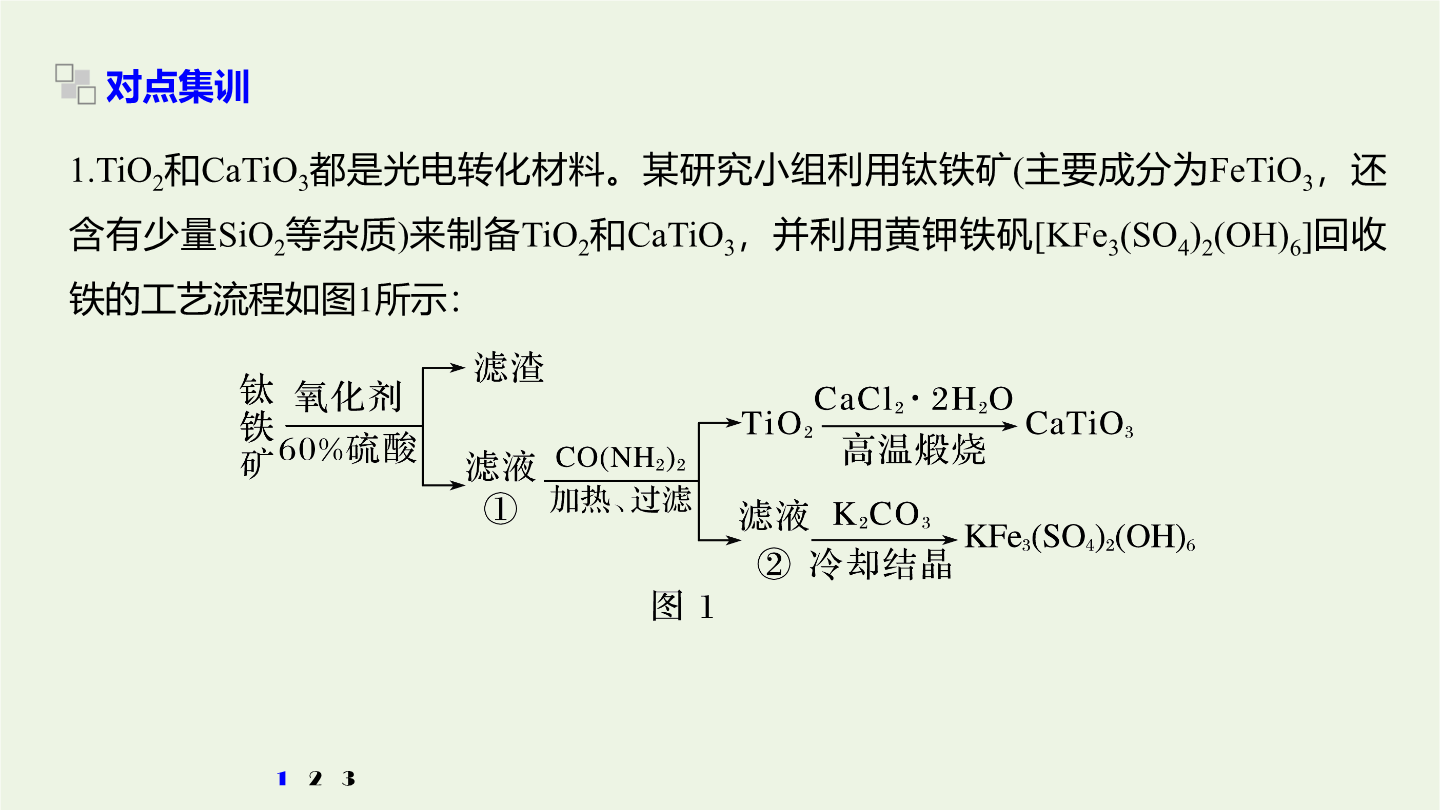
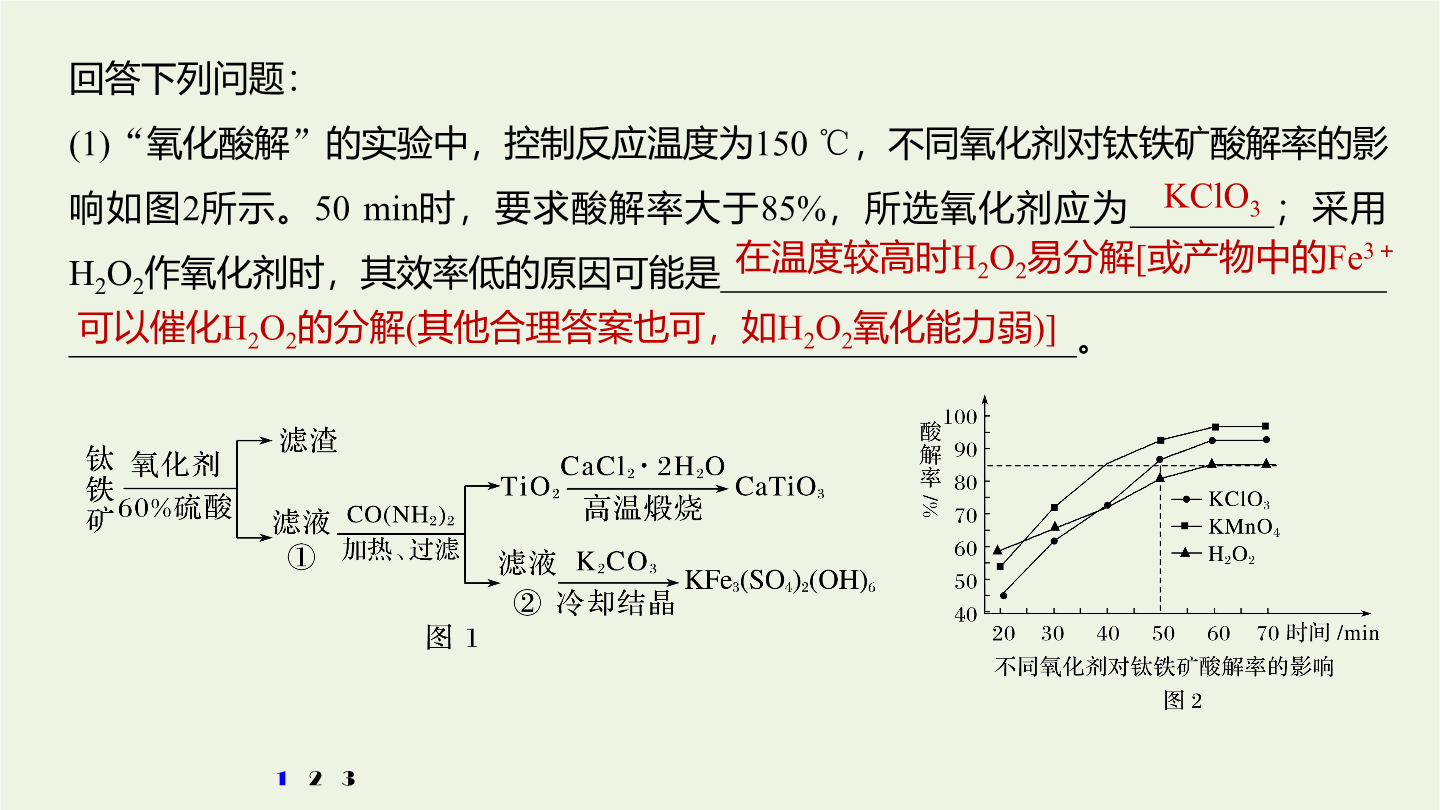
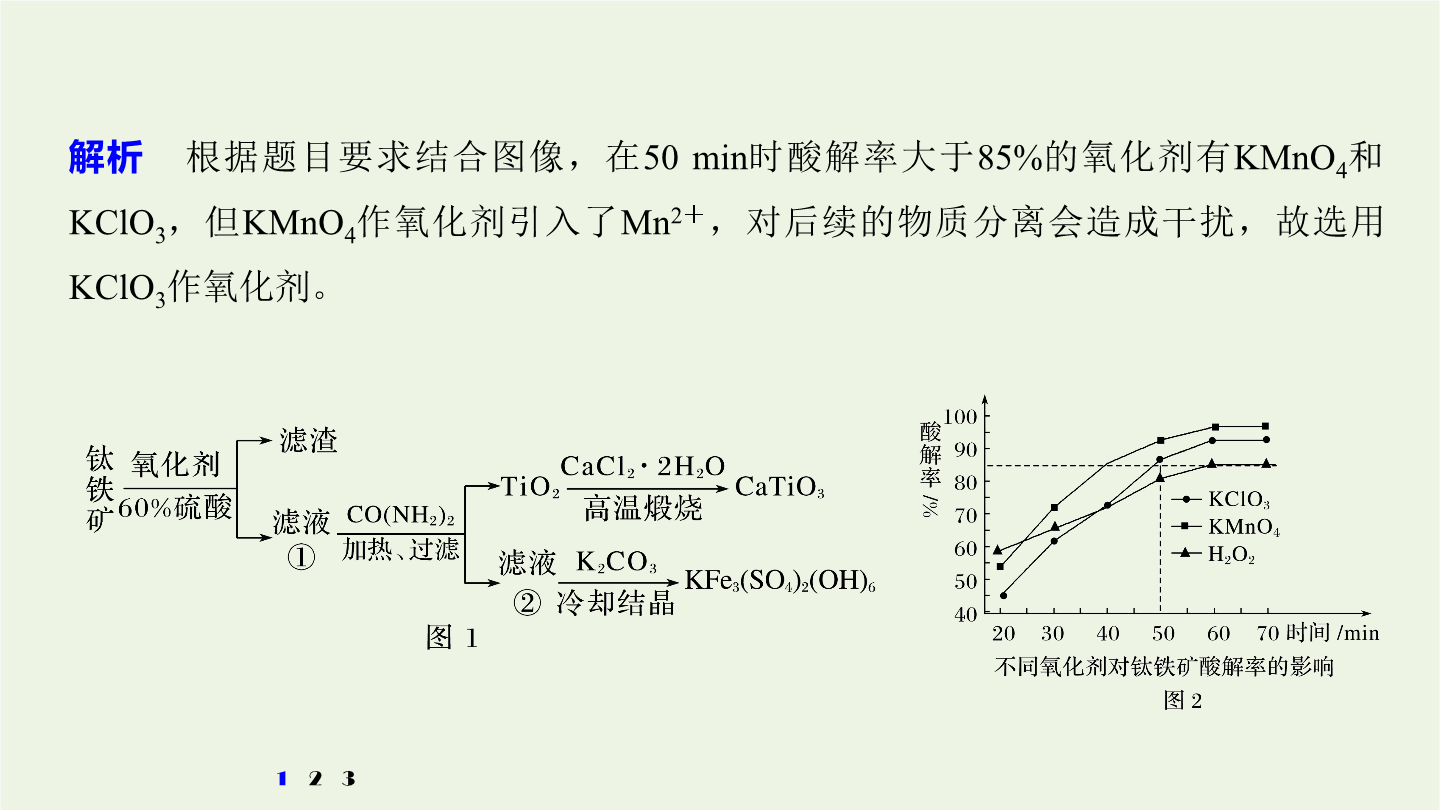
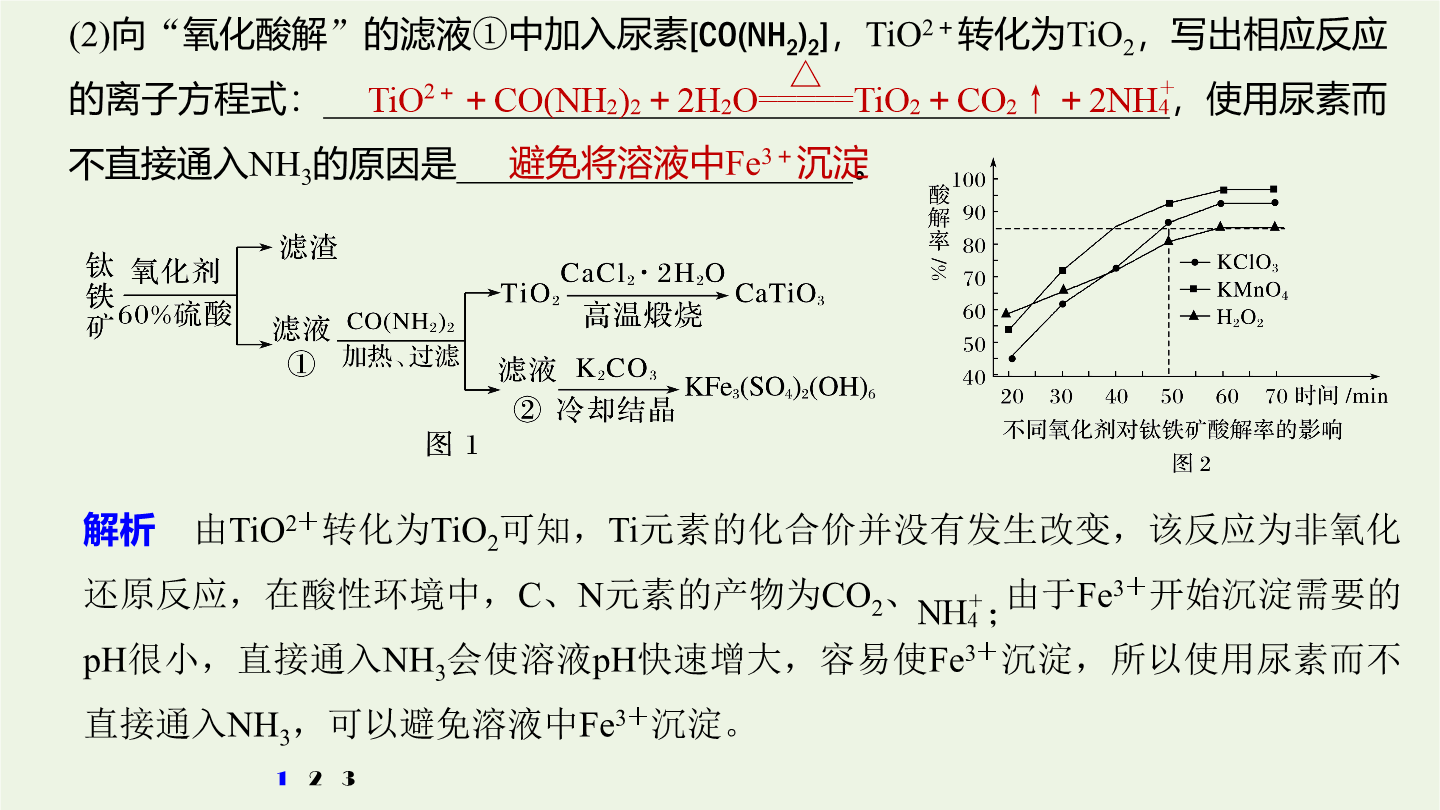
3大题突破整合“精品组件”考向突破一物质制备类工艺流程题考向突破一物质制备类工艺流程题物质制备类工艺流程题的解题策略1.首尾分析法破解无机物制备工艺流程原理与过程。对一些线性流程工艺(从原料到产品为“一条龙”的生产工序)题首先对比分析流程图中第一种物质(原材料)与最后一种物质(产品)找出原料与产品之间的关系弄清生产过程中原料转化为产品的基本原理和分离、提纯产品的化工工艺然后结合题设的问题逐一推敲解答。2.截段分析法对于用同样的原材料生产两种或多种产品(包括副产品)的工艺流程题用截段分析法更容易找到
(通用版)高考化学二轮复习 题型二 无机综合——化工流程综合题的研究逐空突破课件-人教版高三全册化学课件.pptx
2逐空突破打造“精品组件”常考题空1化学式、电子式等化学用语的规范书写常考题空1化学式、电子式等化学用语的规范书写1.化合价体现化合物中不同元素原子或离子的个数比关系的数值。(1)在离子化合物中化合价的数值就是一个原子得失电子的数目失电子的原子为正化合价得电子的原子为负化合价。(2)在共价化合物中化合价的数值就是一个原子跟其他元素原子形成共用电子对的数目电子对偏离的原子为正价电子对偏向的原子为负价。如:分析(1)Na2O2(2)N2H4中各元素的化合价。分析(1)在Na2O2中Na失去一个电子则
(通用版)高考化学二轮复习 题型二 无机综合——化工流程综合题的研究逐空突破课件-人教版高三全册化学课件.pptx
2逐空突破打造“精品组件”常考题空1化学式、电子式等化学用语的规范书写常考题空1化学式、电子式等化学用语的规范书写1.化合价体现化合物中不同元素原子或离子的个数比关系的数值。(1)在离子化合物中化合价的数值就是一个原子得失电子的数目失电子的原子为正化合价得电子的原子为负化合价。(2)在共价化合物中化合价的数值就是一个原子跟其他元素原子形成共用电子对的数目电子对偏离的原子为正价电子对偏向的原子为负价。如:分析(1)Na2O2(2)N2H4中各元素的化合价。分析(1)在Na2O2中Na失去一个电子则

(通用版)高考化学二轮复习 题型二 无机综合——化工流程综合题的研究大题突破教案-人教版高三全册化学教案.docx
无机综合——化工流程综合题的研究考向突破一物质制备类工艺流程题物质制备类工艺流程题的解题策略1.首尾分析法破解无机物制备工艺流程原理与过程。对一些线性流程工艺(从原料到产品为“一条龙”的生产工序)题首先对比分析流程图中第一种物质(原材料)与最后一种物质(产品)找出原料与产品之间的关系弄清生产过程中原料转化为产品的基本原理和分离、提纯产品的化工工艺然后结合题设的问题逐一推敲解答。2.截段分析法对于用同样的原材料生产两种或多种产品(包括副产品)的工艺流程题用截段分析法更容易找到解题的切入点。关键在于看清主、
(通用版)2020高考化学二轮复习 题型二 无机综合——化工流程综合题的研究大题突破课件.pptx
3大题突破整合“精品组件”考向突破一物质制备类工艺流程题考向突破一物质制备类工艺流程题物质制备类工艺流程题的解题策略1.首尾分析法破解无机物制备工艺流程原理与过程。对一些线性流程工艺(从原料到产品为“一条龙”的生产工序)题,首先对比分析流程图中第一种物质(原材料)与最后一种物质(产品),找出原料与产品之间的关系,弄清生产过程中原料转化为产品的基本原理和分离、提纯产品的化工工艺,然后结合题设的问题,逐一推敲解答。2.截段分析法对于用同样的原材料生产两种或多种产品(包括副产品)的工艺流程题,用截段分析法更容易
