
(课标Ⅲ)高考化学一轮复习 专题十七 电化学课件-人教版高三全册化学课件.pptx

猫巷****盟主








亲,该文档总共113页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

(课标Ⅲ)高考化学一轮复习 专题十七 电化学课件-人教版高三全册化学课件.pptx
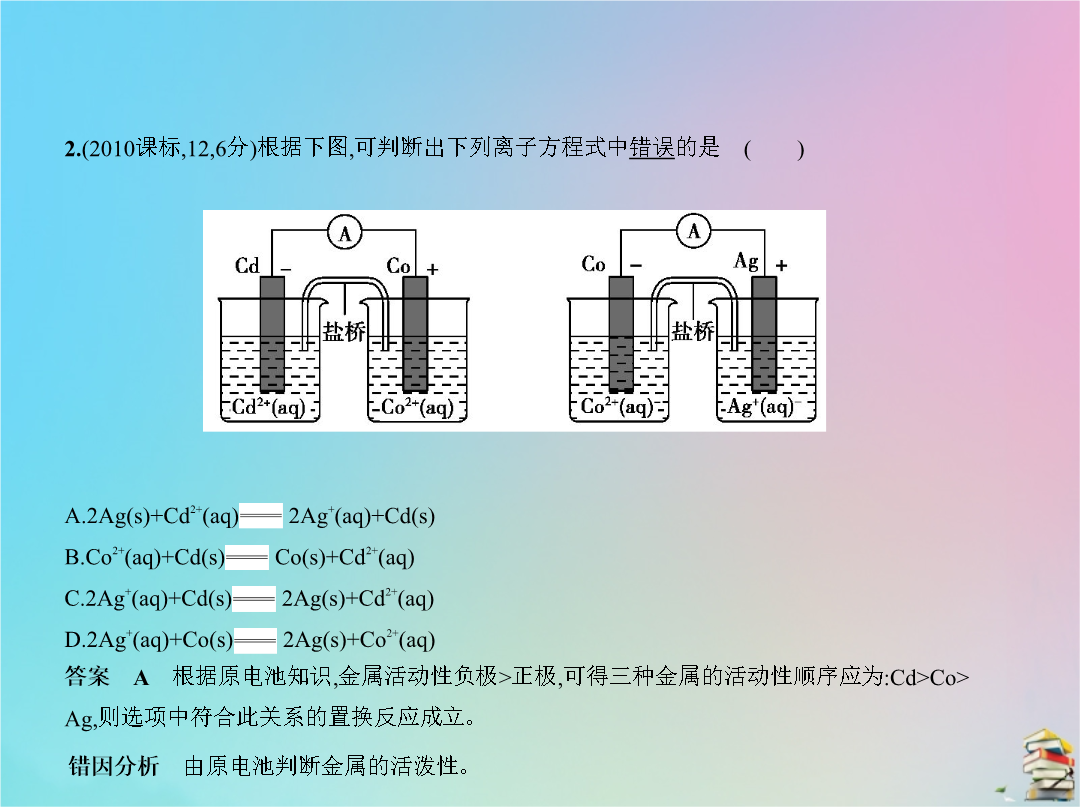
专题十七电化学A组课标Ⅲ卷区题组 下列说法错误的是 ()A.三维多孔海绵状Zn具有较高的表面积所沉积的ZnO分散度高B.充电时阳极反应为Ni(OH)2(s)+OH-(aq)-e- NiOOH(s)+H2O(l)C.放电时负极反应为Zn(s)+2OH-(aq)-2e- ZnO(s)+H2O(l)2.(2010课标126分)根据下图可判断出下列离子方程式中错误的是 ()3.(2011课标116分)铁镍蓄电池又称爱迪生电池放电时的总反应为:Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2

(课标I)高考化学一轮复习 专题十七 电化学课件-人教版高三全册化学课件.pptx
专题十七电化学A组课标Ⅰ卷题组答案B本题涉及原电池的工作原理及应用,以生物燃料电池为载体考查学生接受、吸收、整合化学信息的能力。借助不同形式的能量转化过程,体现了证据推理与模型认知的学科核心素养和关注社会发展、科技进步、生产生活的价值观念。A项,现有工业合成氨的反应条件是高温、高压、催化剂,则题述方法合成氨条件更为温和,同时可将化学能转化为电能,正确;B项,阴(正)极区,在固氮酶催化作用下发生反应N2+6H++6MV+ 2NH3+6MV2+,错误;C项,由B项分析可知正极区N2被还原为NH3,正确;D项,

(课标Ⅱ)高考化学一轮复习 专题一 常用化学计量课件-人教版高三全册化学课件.pptx
专题一常用化学计量考点一物质的量和气体摩尔体积答案B本题涉及阿伏加德罗常数的应用从原子结构、盐的水解、氧化还原反应中电子转移、化学键角度考查考生分析和解决化学问题的能力体现了宏观辨识与微观探析的学科核心素养。A项3g3He的物质的量为1mol其中含有1mol中子即NA个中子;B项由于P 在溶液中发生水解反应故1L0.1mol·L-1的Na3PO4溶液中含有的P 的物质的量小于0.1mol即P 数目小于0.1NA;C项据关系式K2 O7~2Cr3+~6e-可知1molK2

高考化学一轮总复习 专题14 电化学课件-人教版高三全册化学课件.ppt
考试大纲31.热点预测原电池的工作原理、电极反应的书写、电解产物的判断和计算、离子迁移方向和浓度变化等是命题的热点常以选择题或非选择题的形式考查分值约为3~6分。2.趋势分析预计在2018年高考中电解原理在工业生产和生活中的应用、原电池原理在金属腐蚀与防护方面的应用将是命题的方向同时题材会有所创新考生应加以重视。1原电池1原电池1原电池1原电池1原电池2常见的化学电源2常见的化学电源2常见的化学电源2常见的化学电源2常见的化学电源2常见的化学电源2常见的化学电源2

(新课标Ⅰ)高考化学一轮复习 专题十一 电化学课件-人教版高三全册化学课件.ppt
专题十一电化学考点一原电池的工作原理金属的电化学腐蚀与防护1.(2018课标Ⅱ126分)我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将Na-ClO4溶于有机溶剂作为电解液钠和负载碳纳米管的镍网分别作为电极材料电池的总反应为:3CO2+4Na 2Na2CO3+C。下列说法错误的是 ()A.放电时Cl 向负极移动B.充电时释放CO2放电时吸收CO2答案D本题考查二次电池的工作原理。放电时负极反应为:4Na-4e- 4Na+正极反应为3CO2+4e- C+2CO2-3
