
(A版)高考化学总复习 专题十二 电化学基础课件-人教版高三全册化学课件.ppt

景福****90









亲,该文档总共24页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

(A版)高考化学总复习 专题十二 电化学基础课件-人教版高三全册化学课件.ppt
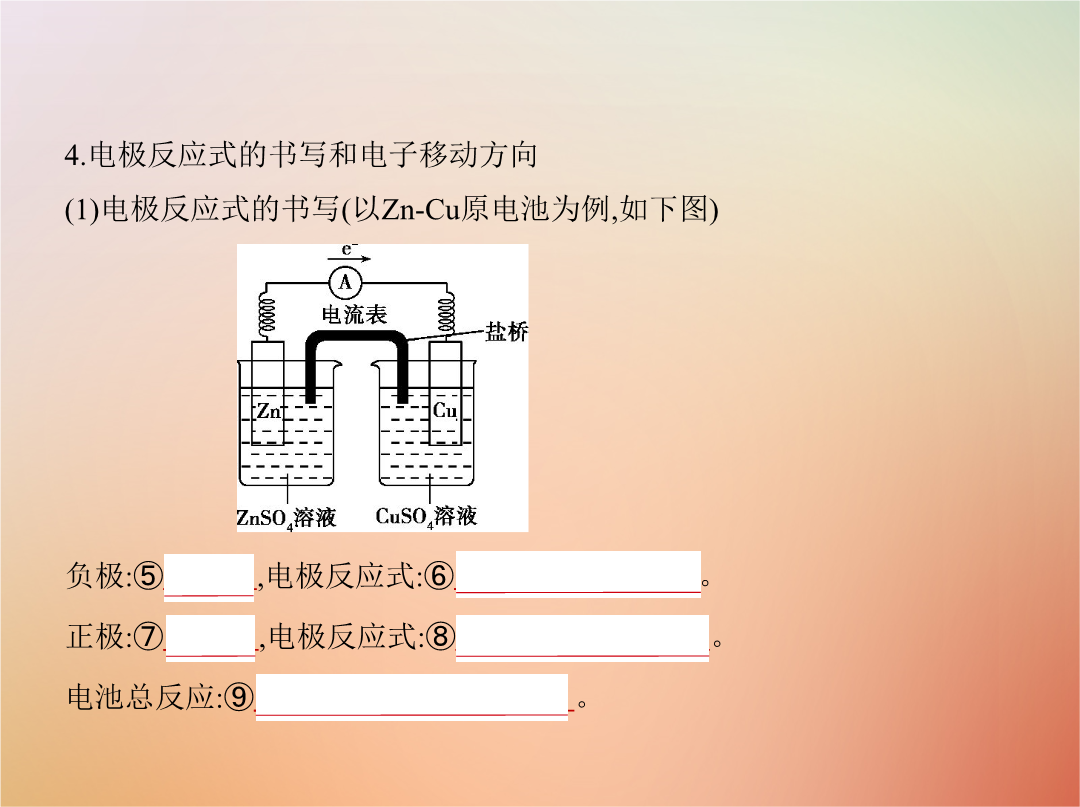
专题十二电化学基础考点一原电池原理及其应用4.电极反应式的书写和电子移动方向(1)电极反应式的书写(以Zn-Cu原电池为例如下图) 负极:⑤Zn电极反应式:⑥Zn-2e- Zn2+。正极:⑦Cu电极反应式:⑧Cu2++2e- Cu。电池总反应:⑨Zn+Cu2+ Zn2++Cu。(2)电子移动方向电子由⑩负极释放经外电路流入 正极电解质溶液中的阳离子移向正极某些阳离子在正极上得电子被 还原形成一个闭合回路。二化

高考化学一轮总复习 专题14 电化学课件-人教版高三全册化学课件.ppt
考试大纲31.热点预测原电池的工作原理、电极反应的书写、电解产物的判断和计算、离子迁移方向和浓度变化等是命题的热点常以选择题或非选择题的形式考查分值约为3~6分。2.趋势分析预计在2018年高考中电解原理在工业生产和生活中的应用、原电池原理在金属腐蚀与防护方面的应用将是命题的方向同时题材会有所创新考生应加以重视。1原电池1原电池1原电池1原电池1原电池2常见的化学电源2常见的化学电源2常见的化学电源2常见的化学电源2常见的化学电源2常见的化学电源2常见的化学电源2

(A版)高考化学总复习 专题十九 烃课件-人教版高三全册化学课件.ppt
专题十九烃考点一烷烃、烯烃的结构和性质2.甲烷的化学性质(1)甲烷的取代反应甲烷在光照下与Cl2发生取代反应反应的化学方程式为④CH4+Cl2 CH3Cl+HCl;CH3Cl+Cl2 CH2Cl2+HCl;CH2Cl2+Cl2 CHCl3+HCl;CHCl3+Cl2 CCl4+HCl。(2)甲烷的氧化反应由于CH4的分子结构稳定所以通常不与强酸、强碱、强氧化剂(如KMnO4)反应但甲烷能燃烧即在点燃的条件下能被氧气氧化。甲烷在空气中燃烧产生⑤淡蓝色的火焰反应的化学方程

高考化学总复习 专题20 烃课件-人教版高三全册化学课件.pptx
专题二十烃考情精解读方法1几类烃的结构和性质比较方法2同分异构体的书写和数目判断方法3烃类燃烧的相关规律方法4有机物分子中原子共线、共面问题考情精解读1.了解有机化合物中碳的成键特征。2.了解有机化合物的同分异构现象能正确书写简单有机化合物的同分异构体。3.掌握常见有机反应类型。4.了解甲烷、乙烯、苯等有机化合物的主要性质及应用。5.以上各部分知识的综合应用考情分析高考有关本专题的考查以选择题为主且较简单常结合生产、生活考查有机物的分类及命名、有机物分子中原子共线和共面问题、同分

(A版)高考化学总复习 专题二 物质的量课件-人教版高三全册化学课件.ppt
专题二物质的量考点一物质的量、气体摩尔体积3.摩尔质量单位物质的量的物质所具有的④质量叫物质的摩尔质量符号是M单位是g·mol-1;它与1mol物质的质量的区别与联系是:单位不同当质量以克为单位时数值⑤相等。4.气体摩尔体积单位物质的量的气体所占的⑥体积叫气体摩尔体积用符号Vm表示常用单位是L·mol-1;它的大小与温度、压强有关在标准状况下任何气体的摩尔体积都约等于⑦22.4L·mol-1。二物质的量与其他量之间的关系若以M表示A的摩尔质量Vm表示
