
高中化学选修四-酸碱中和滴定省名师优质课赛课获奖课件市赛课一等奖课件.ppt

可爱****乐多








亲,该文档总共25页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

高中化学选修四-酸碱中和滴定省名师优质课赛课获奖课件市赛课一等奖课件.ppt
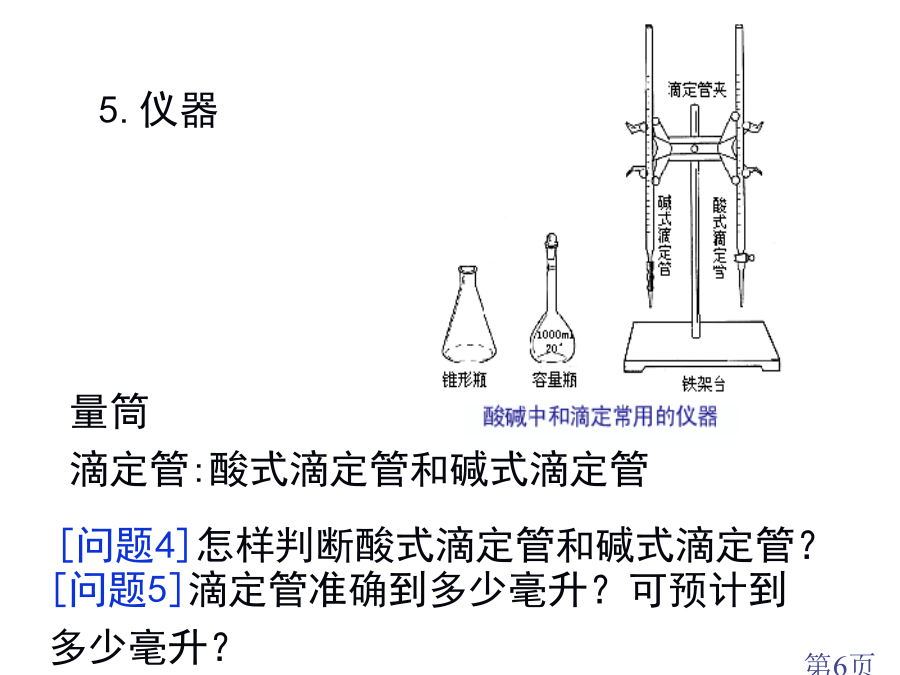
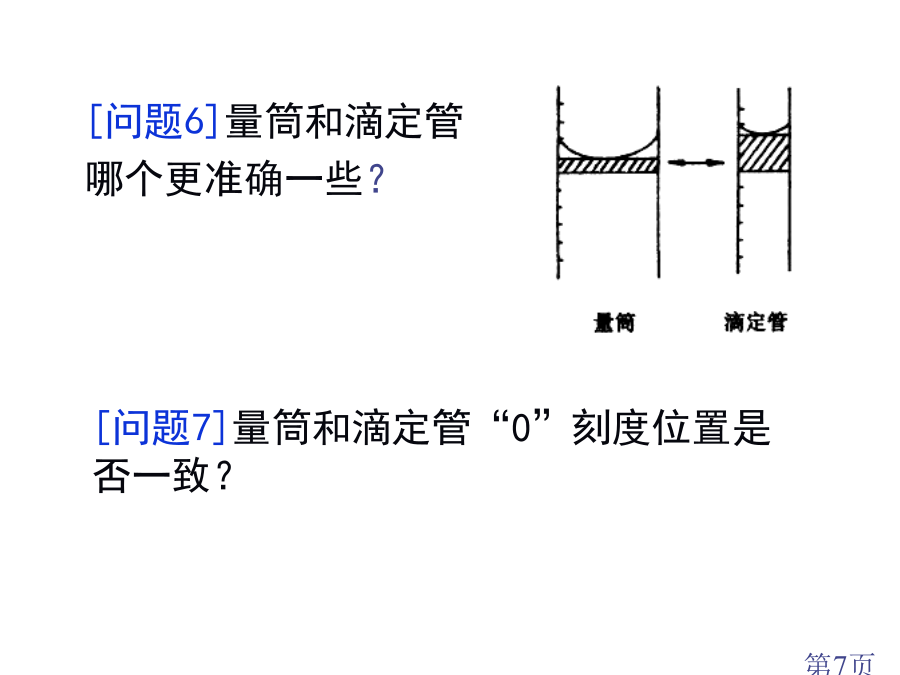
酸碱中和滴定[问题1]用什么方法能够比较准确地测得这瓶未知浓度NaOH溶液浓度?一、酸碱中和反应原理[问题2]利用这种方法关键问题是什么?4.关键:5.仪器[问题7]量筒和滴定管“0”刻度位置是否一致?[问题8]用什么试剂可指示酸碱恰好完全反应?酸碱指示剂:酚酞[练习1]在20.00mL0.1000mol/L盐酸中,逐滴滴入0.1000mol/LNaOH溶液40.00mL。⑴判断以下情况下溶液pH。①未滴NaOH溶液时HClpH;②滴加NaOH溶液到完全反应还差一滴(一滴溶液体积是0.04mL),这时溶液

苏教版酸碱中和滴定名师优质课赛课一等奖市公开课获奖课件.pptx
酸碱中和滴定测定和控制溶液酸碱性,对生产生活和科学研究等都含有主要意义。工业:溶液pH影响产品质量和产量农业:不一样农作物对土壤酸碱性要求不一样环境保护:废水也分为酸性废水和碱性废水等现在有一瓶失去标签盐酸,为了测出其真实浓度.请说出有哪些试验方法。学生讨论方法酸碱中和滴定——利用已知浓度酸(或碱)去滴定一定体积未知浓度碱(或酸),经过测定反应完全时消耗已知浓度酸(或碱)体积,从而推算出未知浓度碱(或酸)浓度方法。1、酸碱中和滴定原理?2、酸碱中和滴定关键?3、酸碱中和滴定所需仪器及操作?4、酸碱中和滴定

中和滴定复习课件(赵)省名师优质课赛课获奖课件市赛课百校联赛优质课一等奖课件.ppt
中和滴定1、中和滴定原理是什么?2、滴定所使用仪器主要有?3、滴定过程中眼睛、手有何注意事项?4、怎样选择指示剂?5、中和滴定普通用标准液滴定待测液,能否用待测液滴定标准液?6、怎样判断滴定终点?一、中和滴定概念酸碱中和滴定所需仪器滴定管结构试验关键:1、滴定准备:查—洗—润—注—排—调—读—记中和滴定过程中,轻易产生误差6方面:①洗涤仪器(滴定管、移液管、锥形瓶);②气泡;③体积读数(仰视、俯视);④指示剂选择不妥;⑤杂质影响;⑥操作(如用力过猛引发待测液外溅等)。分析方法:1、未用标准盐酸标准液润洗酸

化学酸碱中和滴定新人教版选修4省公共课一等奖全国赛课获奖课件.pptx
第二课时酸碱中和滴定2.仪器和试剂(1)仪器:、、、、.(2)试剂:标准液(盐酸),待测液(NaOH溶液).指示剂:或.3.试验步骤(1)滴定前准备①检验:使用滴定管前,首先要检验.②润洗:加入酸、碱反应液之前,洁净酸式滴定管和碱式滴定管分别用润洗遍.③装液:分别将酸、碱反应液加入此酸式、碱式滴定管中,使液面位于“0”刻度以上处.④调液:调整活塞,使滴定管尖嘴部分充满反应液,并使液面处于或.⑤放液:从碱式滴定管中放出一定量NaOH溶液于锥形瓶中,并滴2~3滴指示剂.(2)滴定①左手握,右手.②眼睛注视.③

苏教版酸碱中和滴定公开课一等奖市赛课获奖课件.pptx
酸碱中和滴定测定和控制溶液旳酸碱性,对生产生活和科学研究等都具有主要意义。工业:溶液旳pH影响产品质量和产量农业:不同农作物对土壤酸碱性要求不同环境保护:废水也分为酸性废水和碱性废水等目前有一瓶失去标签旳盐酸,为了测出其真实浓度.请说出有哪些试验措施。学生讨论措施酸碱中和滴定——利用已知浓度旳酸(或碱)去滴定一定体积未知浓度旳碱(或酸),经过测定反应完全时消耗已知浓度旳酸(或碱)旳体积,从而推算出未知浓度旳碱(或酸)旳浓度措施。1、酸碱中和滴定原理?2、酸碱中和滴定旳关键?3、酸碱中和滴定所需旳仪器及操作
