
化学原理7化学反应的速率省公共课一等奖全国赛课获奖课件.pptx

你的****书屋








亲,该文档总共41页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

化学原理7化学反应的速率省公共课一等奖全国赛课获奖课件.pptx
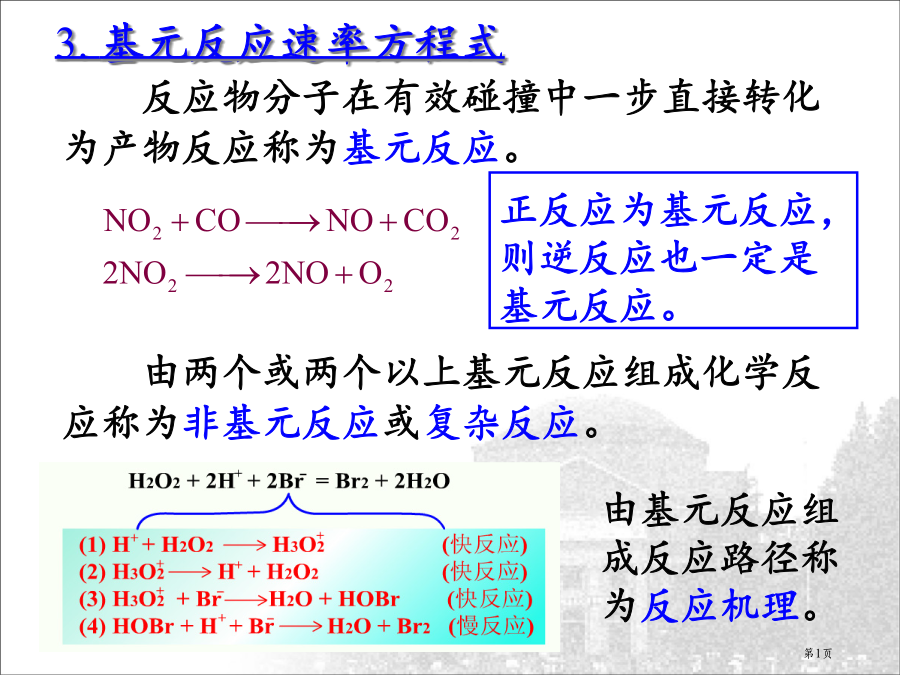
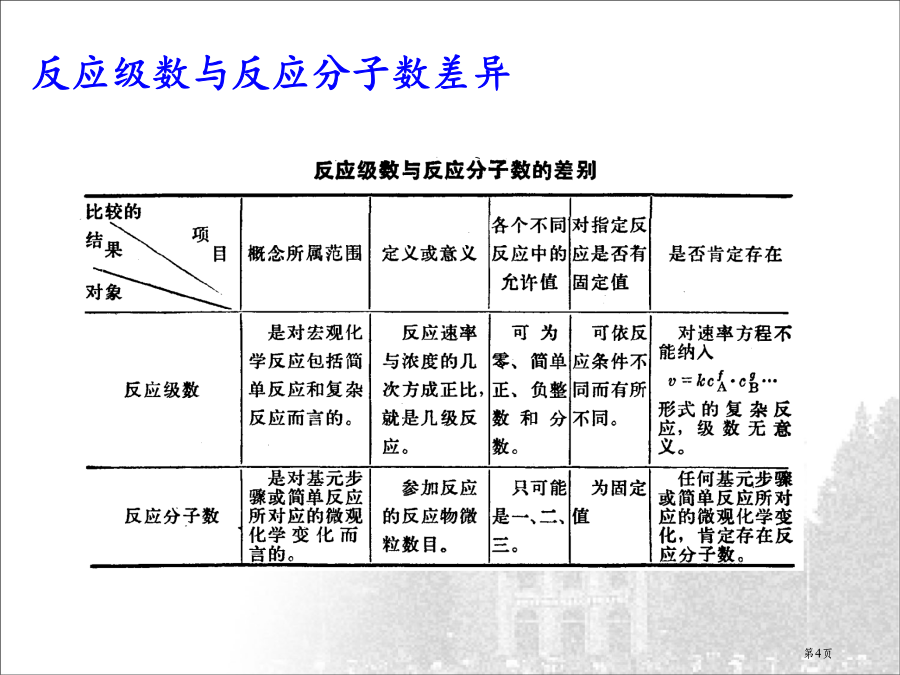
3.基元反应速率方程式恒温下,基元反应反应速率与各反应物浓度系数次方乘积成正比,称为基元反应质量作用定律。4.反应分子数反应级数与反应分子数差异在基元反应中,反应级数与反应分子数数值相等,但反应分子数是微观量,反应级数是宏观量,二者有本质区分。5.复杂反应速率方程式a.k[O3]2b.k[O3][O]c.k[O3]2[O2]d.k[O3]2[O2]-1反应速率与反应机理关系:6.速率常数k3.2浓度与时间定量关系对于一级反应:aA产物ln[A]反应物消耗掉二分之一所需时间放射性碳确定年代植物进行光合

化学反应的速率省公共课一等奖全国赛课获奖课件.pptx
FujianNormalUniversityFujianNormalUniversityFujianNormalUniversityFujianNormalUniversityFujianNormalUniversityFujianNormalUniversityFujianNormalUniversityFujianNormalUniversityFujianNormalUniversityFujianNormalUniversityFujianNormalUniversityFujianNormalU

化学反应速率-(2)省公共课一等奖全国赛课获奖课件.pptx
化学反应速率化学热力学有些化学反应速率很快反应釜中乙烯聚合过程需要数小时,室温下塑料或橡胶老化速率按年计,而地壳内煤或石油形成要经过几十万年时间。不一样化学反应,反应速率不一样,同一反应在不一样条件下进行时反应速率也不相同。怎样定量地表示一个化学反应快慢呢?对于普通化学反应:aA+bB=gG+dD因d=dnB/B所以=d/dt=B-1dnB/dt对有限量改变=B-1nB/t若反应体系体积为V,且不随时间而改变,则可用下式表示化学反应速率:瞬时速率instantaneousrate:v=

化学反应速率图像省公共课一等奖全国赛课获奖课件.pptx
一、“v–t”图象二、“v–T(或P)”图象(每种图象均按不可逆反应和可逆反应两种情况分析)一、“v–t”图象氯酸钾和亚硫酸氢钠发生氧化还原反应,用ClO3-表示反应速率如图曲线所表示,已知ClO3-氧化性随c(H+)增大而增强,相关方程式为:ClO3-+3HSO3-==Cl-+3H++3SO42-(1)反应开始时反应速率加紧原因是____________________________________________________________。(2)反应后期反应速率下降原因是___________

化学反应的速率和限度省公共课一等奖全国赛课获奖课件.pptx
第三节化学反应速率和限度思索与交流:二、化学反应程度P44可逆反应1、化学平衡状态定义:一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分浓度保持不变状态三、化学反应条件控制思索与交流:角色扮演演示文稿123后等怎样提升煤燃烧效率?归纳:为何要控制反应条件:练习:1、化学反应速率及其表示方法。2、影响化学反应速率原因。3、化学反应程度和化学平衡状态,以及化学平衡状态特征判断。4、化学反应条件控制。
