
新版影响化学反应速率的因素市公开课一等奖百校联赛获奖课件.pptx

和蔼****娘子








亲,该文档总共38页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

新版影响化学反应速率的因素市公开课一等奖百校联赛获奖课件.pptx
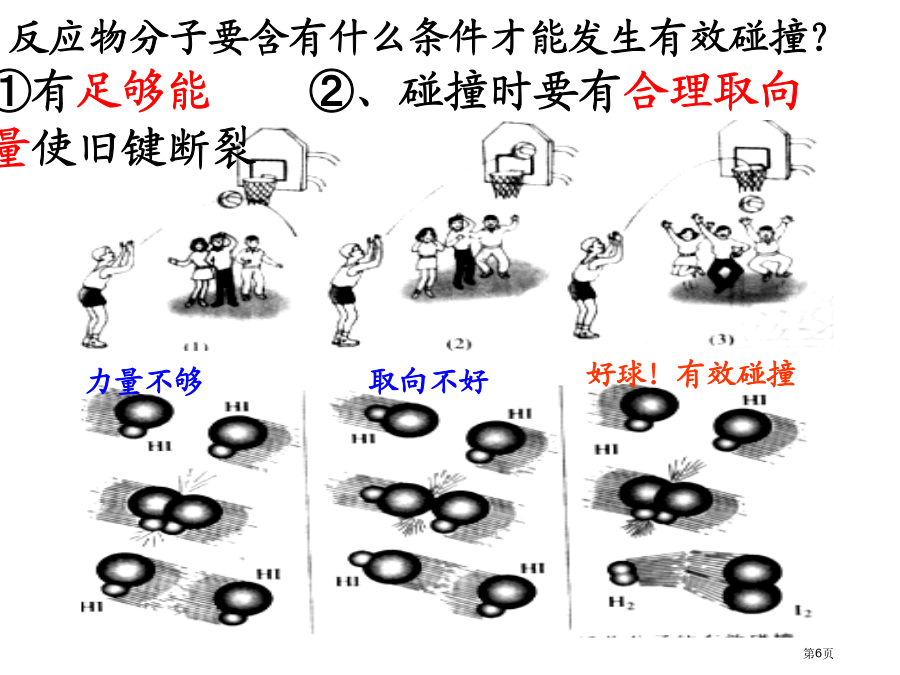
影响化学反应速率的因素1、在通常情况下,Na与水反应和Mg与水反应哪个猛烈(反应速率快)?为何?2、将等物质量碳酸钠与碳酸氢钠放入等体积等浓度盐酸中,产生CO2速率哪个较快?为何?3、石油形成要多少年?炸药爆炸呢?以上说明化学反应速率决定原因是什么?思索:外因:①浓度:②压强:③温度:④催化剂:⑤其它原因:光、颗粒大小、溶剂等。一、浓度对反应速率影响化学反应碰撞理论:力量不够在化学上,把能够发生有效碰撞分子叫活化分子.特点是:分子运动能够发生化学反应碰撞。浓度对反应速率影响1、浓度对化学反应速率影响。注意

影响化学反应速率的因素新版市公开课一等奖百校联赛获奖课件.pptx
第二节影响化学反应速率原因影响反应速率原因一.浓度对化学反应速率影响二、压强对反应速率影响压强对化学反应速率影响D.注意“真”变和“假”变。若体系压强改变而使反应物或生成物浓度发生改变即“真”变,不然是“假”变。【结论】其它条件不变,升高温度,化学反应速率增大,降低温度,化学反应速率减小。四、催化剂对化学反应速率影响其它原因:如光照、反应物固体颗粒大小、电磁波、超声波、溶剂性质等,也会对化学反应速率产生影响。练习题2、NO和CO都是汽车尾气中物质,它们能很迟缓地反应生成CO2和N2,对此反应相关叙述中不正

影响化学反应速率的因素市公开课一等奖百校联赛获奖课件.pptx
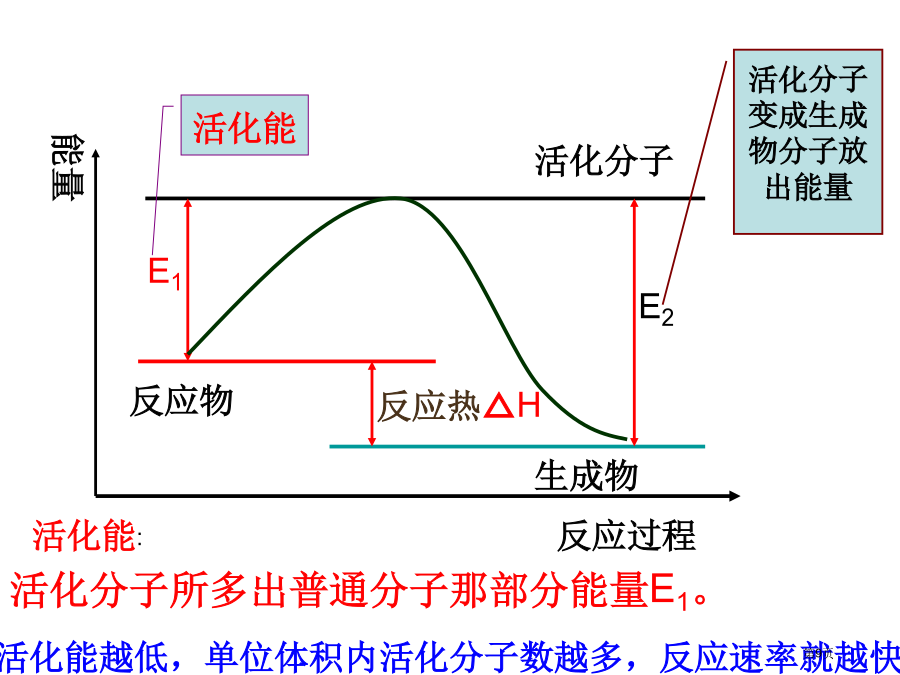
第二章化学反应速率和化学平衡为何有碰撞能够发生反应,而有不能发生反应?与哪些因素相关系?有效碰撞没适当取向n活=n总×活%对于“活化能大小即使意味着普通分子成为活化分子难易,不过却对这个化学反应前后能量改变并不产生任何影响”这一句话怎样了解?1、在通常情况下,Na与水反应和Mg与水反应哪个猛烈(反应速率快)?为何?2、将等物质量碳酸钠与碳酸氢钠放入等体积等浓度盐酸中,产生CO2速率哪个较快?为何?3、石油形成要多少年?炸药爆炸呢?以上说明化学反应速率决定原因是什么?影响反应速率原因一、浓度对反应速率影响浓

化学反应速率市公开课一等奖百校联赛获奖课件.pptx
第一节化学反应速率节日焰火熔洞形成慢慢锈蚀铜钟第一节化学反应速率对于化学反应来说,当体系为气态或溶液时,化学反应速率用单位时间内反应物或生成物浓度改变来表示。在容积不变反应器中,通常是用单位时间内反应物浓度降低或生成物浓度增加(均取正值)来表示。【例题1】在2L密闭容器中,加入1molN2和3molH2,发生N2+3H2=2NH3,在2s末时,测得容器中含有0.4molNH3,求该反应化学反应速率。同一反应反应速率用不一样物质表示,其数值能够可能不一样,但所表示意义是相同。所以应注明是由哪种物质表示。同一

影响化学反应速率因素市公开课一等奖百校联赛特等奖课件.pptx
影响化学反应速率原因化学反应速率大小影响速率原因∶二、外因反应物浓度、温度、体系压强、催化剂、溶剂、光辐射、放射线辐射、超声波、电弧、强磁场、高速研磨、颗粒大小等等1.浓度对化学反应速率影响2.压强对化学反应速率影响c.注意“真”变和“假”变。若体系压强改变而使反应物或生成物浓度发生改变即“真”变,不然是“假”变。3.温度对化学反应速率影响4.催化剂对化学反应速率影响1、滴加0.1mol/L三氯化铁溶液到过氧化氢中比滴加0.1mol/L硫酸铜溶液到过氧化氢中,使过氧化氢分解速率快很多,所以过氧化氢分解用三
