
(浙江版)2021高考化学一轮复习 专题六 化学能与电能的转化课件.pptx

Ro****44







亲,该文档总共26页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

(浙江版)2021高考化学一轮复习 专题六 化学能与电能的转化课件.pptx
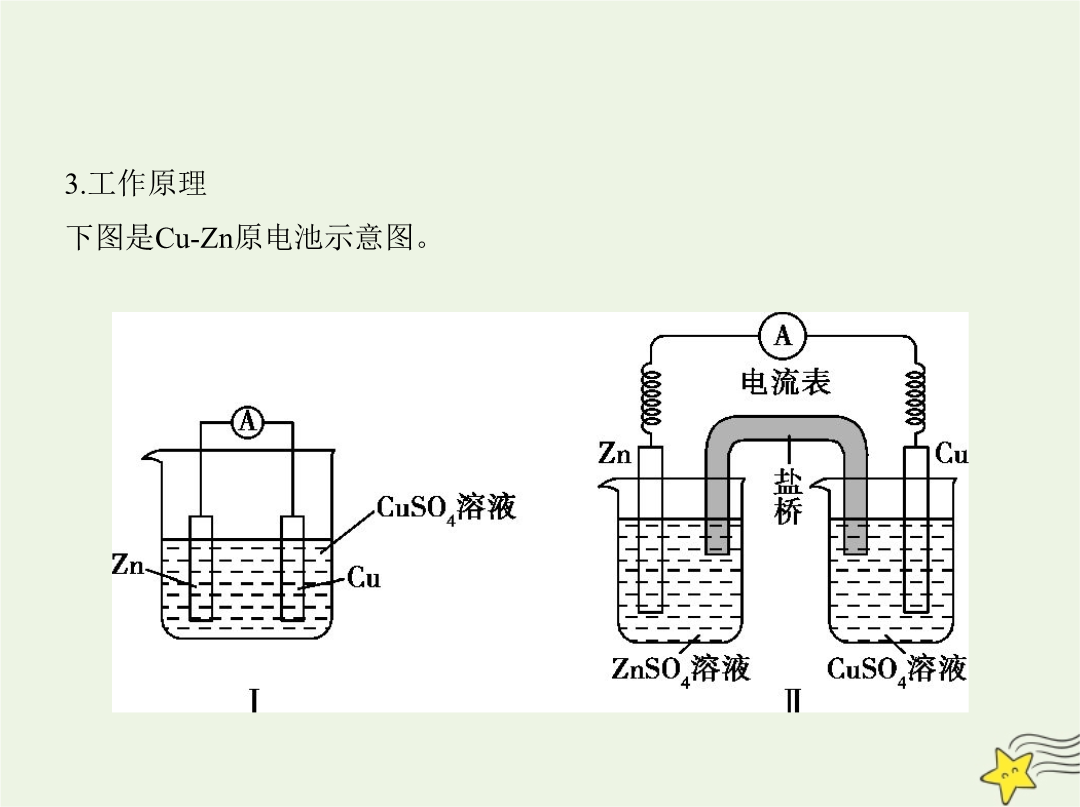
考点一原电池原理及其应用考点基础1.原电池的概念把①化学能转化为②电能的装置。2.原电池的构成条件(1)有两个③活动性不同的电极。(2)将电极插入④电解质溶液中并形成⑤闭合回路。(3)能自发进行的⑥氧化还原反应。3.工作原理下图是Cu-Zn原电池示意图。 电极材料4.原电池原理的应用(1)比较金属的活动性强弱原电池中,一般活动性强的金属作负极,而活动性弱的金属(或非金属)作正极。(2)加快化学反应速率由于形成了原电池,导致反应速率加快。如Zn与稀硫酸反应制氢气时,可向溶液中滴加少量CuSO4溶液,形成Cu

2021高考化学一轮复习 专题六 化学能与电能的转化课件.pptx
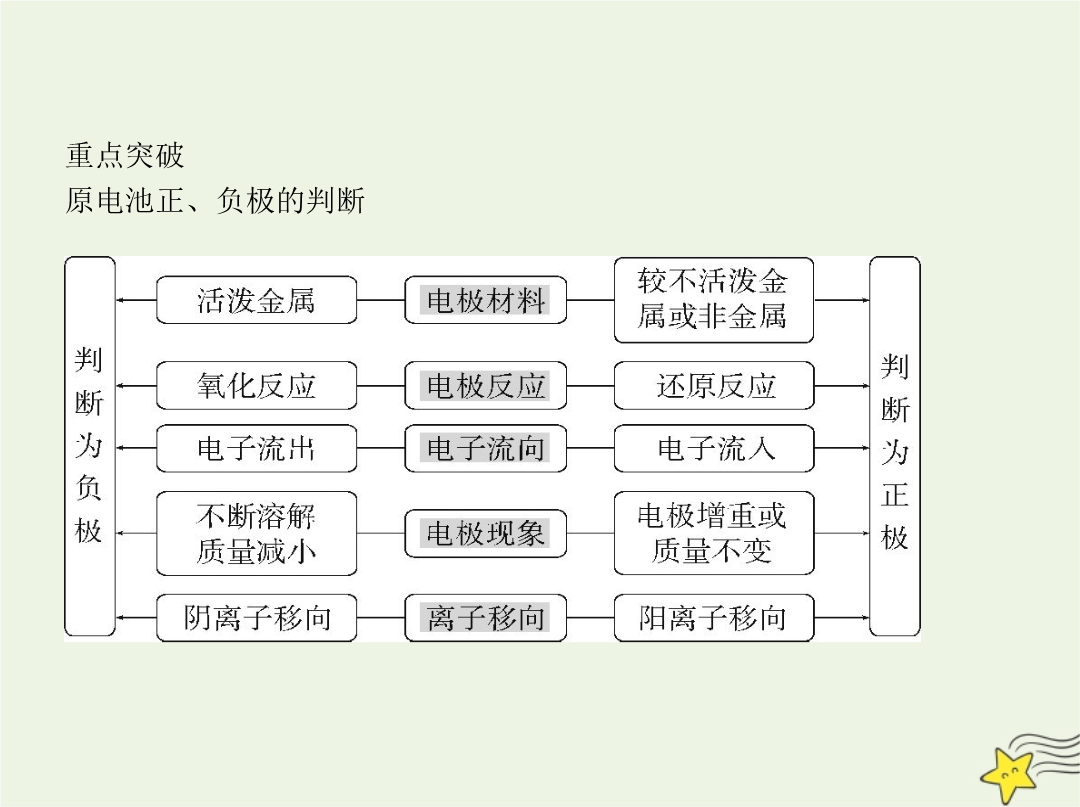
考点一原电池原理及其应用3.原电池的两极负极:通常是活泼性较强的金属,发生③氧化反应。正极:通常是活泼性较弱的金属或能导电的非金属,发生④还原反应。4.电极反应式的书写和电子移动方向(1)电极反应式的书写(以Zn-Cu原电池为例,如图) 负极:⑤Zn,电极反应式:⑥Zn-2e- Zn2+。正极:⑦Cu,电极反应式:⑧Cu2++2e- Cu。电池总反应:⑨Zn+Cu2+ Zn2++Cu。(2)电子移动方向电子由⑩负极释放,经外电路流入 正极,电解质溶液中的阳离子移向正极,某些阳离子在正极上得电子被 还原,形
(浙江版)2021高考化学一轮复习 专题六 化学能与电能的转化精练(含解析).docx
-25-专题六化学能与电能的转化探考情悟真题【考情探究】考点考纲内容考试要求5年考情预测热度考题示例难度关联考点原电池原理及其应用(1)原电池的概念a☆☆☆☆☆(2)铜—锌原电池的原理及电极反应式b2015浙江10月选考,16,2分易氧化还原反应★☆☆☆☆(3)原电池的构成条件b☆☆☆☆☆(4)常见化学电源c2019浙江4月选考,12,2分易氧化还原反应★★☆☆☆(5)银锌电池、铅蓄电池、燃料电池的工作原理与应用价值b2017浙江4月选考,17,2分易氧化还原反应★★☆☆☆(6)原电池的构造与工作原理,盐

(浙江版)2021高考化学一轮复习 专题六 化学能与电能的转化精练(含解析).docx
专题六化学能与电能的转化探考情悟真题【考情探究】考点考纲内容考试要求5年考情预测热度考题示例难度关联考点原电池原理及其应用(1)原电池的概念a☆☆☆☆☆(2)铜—锌原电池的原理及电极反应式b2015浙江10月选考,16,2分易氧化还原反应★☆☆☆☆(3)原电池的构成条件b☆☆☆☆☆(4)常见化学电源c2019浙江4月选考,12,2分易氧化还原反应★★☆☆☆(5)银锌电池、铅蓄电池、燃料电池的工作原理与应用价值b2017浙江4月选考,17,2分易氧化还原反应★★☆☆☆(6)原电池的构造与工作原理,盐桥的作用

(湖南版)2021高考化学一轮复习 专题7 化学能与电能的转化课件.pptx
考点一原电池原理及其应用一、原电池的工作原理1.原电池将①化学能转化为②电能的装置。2.构成条件(1)具有两个活泼性不同的电极(金属和金属或金属和导电的非金属)。(2)电解质溶液。(3)形成闭合回路。3.原电池的两极负极:活泼性较③强的金属,发生④氧化反应。正极:活泼性较⑤弱的金属或能导电的非金属,发生⑥还原反应。4.电极反应式的书写和电子移动方向(1)电极反应式的书写(以Zn-Cu原电池为例,如下图) 负极:⑦Zn,电极反应式:⑧Zn-2e- Zn2+。正极:⑨Cu,电极反应式:⑩Cu2++2e- Cu
