
(江苏专用版)2020版高考化学总复习 专题五 第1讲 化学反应中的热效应、焓变课件.pptx

猫巷****正德







亲,该文档总共89页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

(江苏专用版)2020版高考化学总复习 专题五 第1讲 化学反应中的热效应、焓变课件.pptx
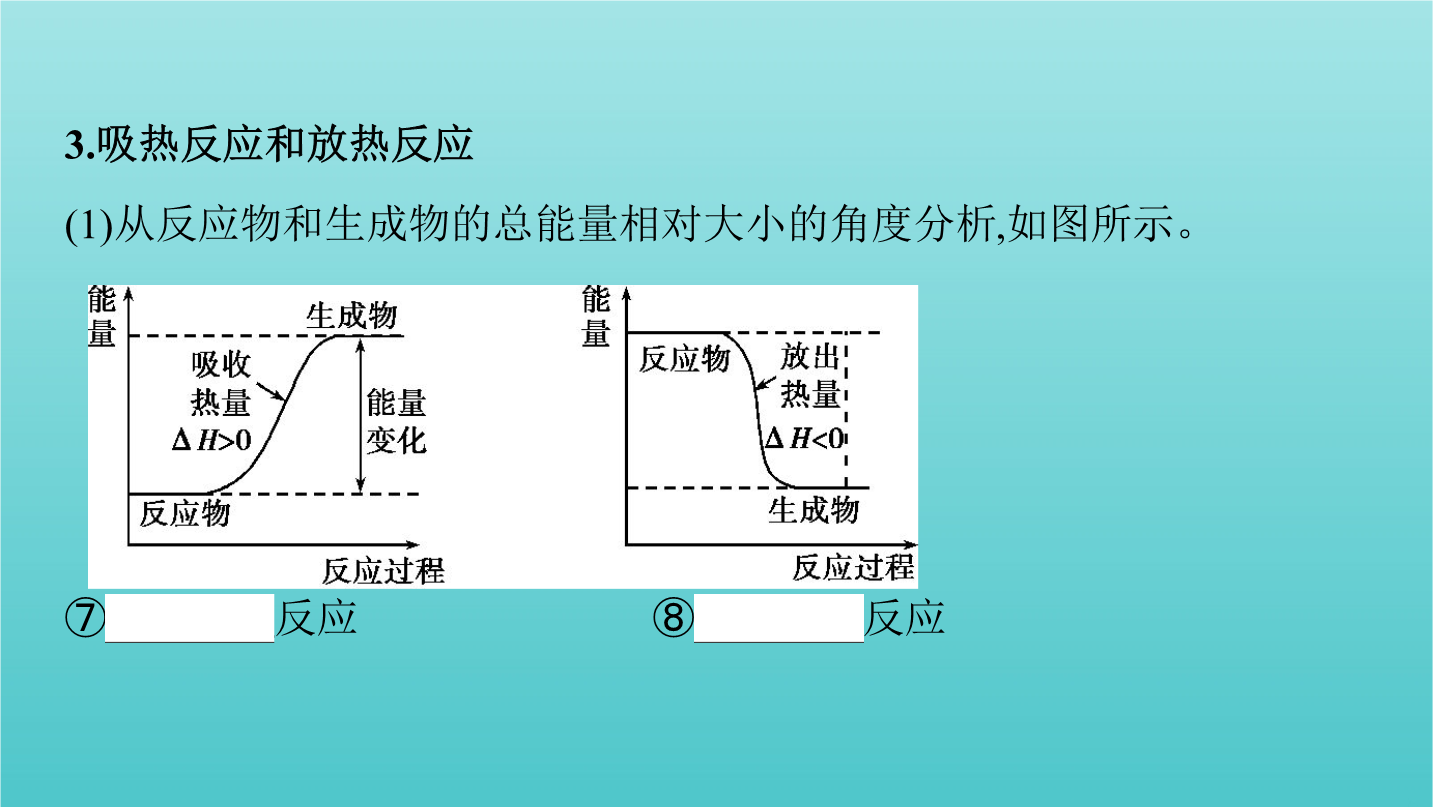
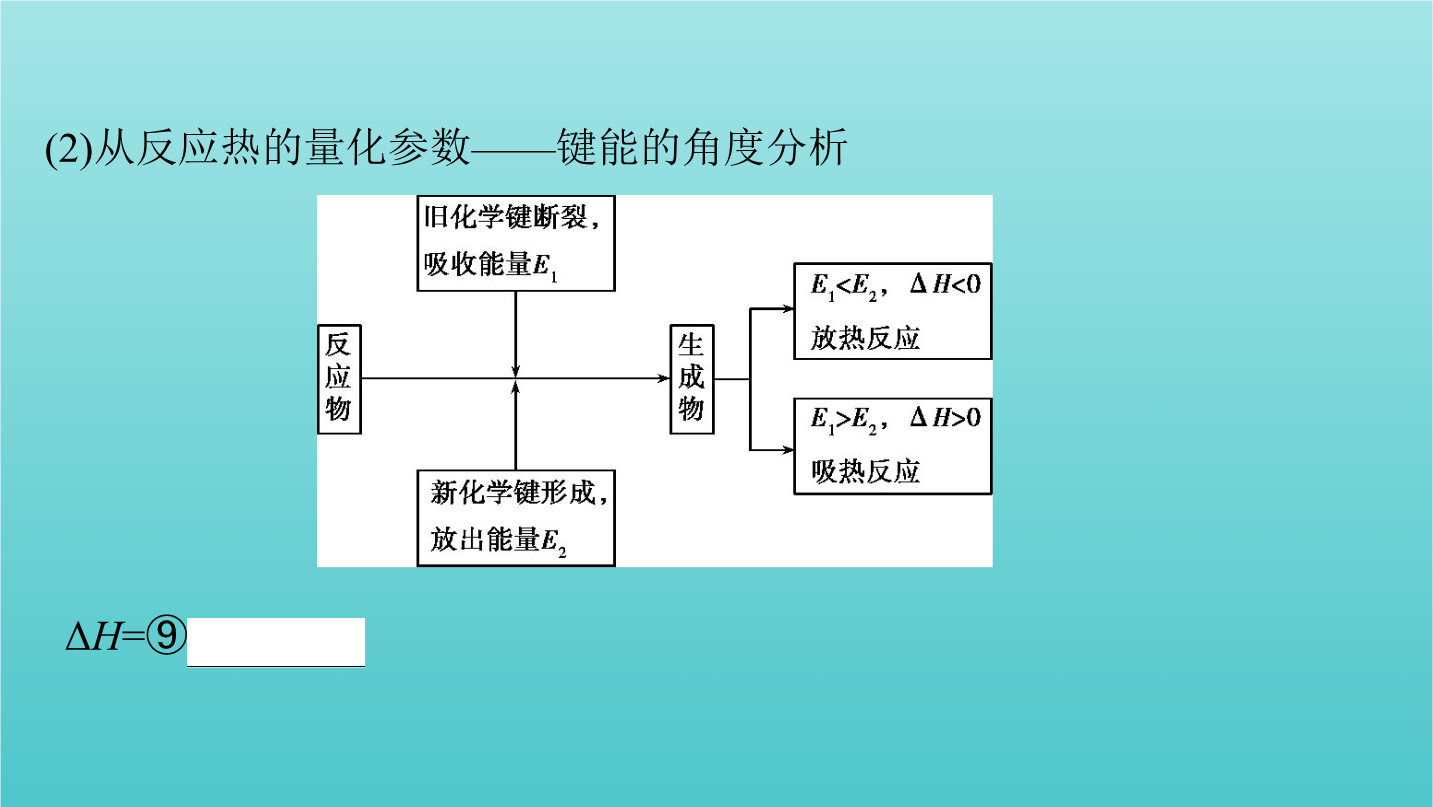
第1讲化学反应中的热效应、焓变考点一焓变与反应热考点一焓变与反应热2.焓变(1)定义:在恒温、恒压的条件下,化学反应过程中吸收或释放的热量称为反应的焓变。(2)符号:⑤ΔH。(3)单位:⑥kJ·mol-1或kJ/mol。3.吸热反应和放热反应(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。 ⑦吸热反应⑧放热反应 ΔH=⑨E1-E2换反应;物质的缓慢氧化等。吸热反应:大多数分解反应;盐的水解;Ba(OH)2·8H2O与NH4Cl的反应;碳和水蒸气、C和CO2的反应等。1.【易错辨析】判断正误,正

(江苏专用版)高考化学总复习 专题五 第1讲 化学反应中的热效应、焓变课件-人教版高三全册化学课件.pptx
第1讲化学反应中的热效应、焓变考点一焓变与反应热考点一焓变与反应热2.焓变(1)定义:在恒温、恒压的条件下化学反应过程中吸收或释放的热量称为反应的焓变。(2)符号:⑤ΔH。(3)单位:⑥kJ·mol-1或kJ/mol。3.吸热反应和放热反应(1)从反应物和生成物的总能量相对大小的角度分析如图所示。 ⑦吸热反应⑧放热反应 ΔH=⑨E1-E2换反应;物质的缓慢氧化等。吸热反应:大多数分解反应;盐的水解;Ba(OH)2·8H2

2020版高考化学(江苏专用版)新攻略总复习练习:专题五-第1讲 化学反应中的热效应、焓变 WORD版含解析.docx
第1讲化学反应中的热效应、焓变一、单项选择题1.化学与社会可持续发展密切相关。下列做法不合理的是()A.将废旧电池集中深埋,防止重金属污染B.改善能源结构,大力发展太阳能、风能等清洁能源C.推广碳捕集和转化成化工原料技术,逐步实现二氧化碳零排放D.采用纳米TiO2光触媒技术,将装修材料中释放的HCHO转化为无害物质答案AA项,废电池中有重金属离子以及酸液,会污染土壤,错误。2.(2018宿迁期末)化学能与热能、电能等可以相互转化,关于化学能与其他能量相互转化的说法正确的是()A.图1所示的装置能将化学能转

(江苏专用版)2020版高考化学总复习 专题六 第1讲 化学反应速率课件.pptx
第1讲化学反应速率考点一化学反应速率的概念及计算考点一化学反应速率的概念及计算 特别提醒(1)化学反应速率指的是一段时间内的平均速率而不是瞬时速率,且都取正值。(2)同一化学反应,相同条件下不同物质表示的反应速率,其数值可能不同,但表示的意义相同。3.化学反应速率与化学计量数的关系对于已知反应:mA(g)+nB(g) pC(g)+qD(g),在同一段时间内,用不同物质来表示该反应的化学反应速率,当单位相同时,化学反应速率的数值之比等于这些物质在化学方程式中的⑥化学计量数之比。即v(A)∶v(B)∶v(C)

课件-全国-2019_(江苏专用版)2020版高考化学总复习 专题六 第1讲 化学反应速率课件.pptx
第1讲化学反应速率考点一化学反应速率的概念及计算考点一化学反应速率的概念及计算 特别提醒(1)化学反应速率指的是一段时间内的平均速率而不是瞬时速率,且都取正值。(2)同一化学反应,相同条件下不同物质表示的反应速率,其数值可能不同,但表示的意义相同。3.化学反应速率与化学计量数的关系对于已知反应:mA(g)+nB(g) pC(g)+qD(g),在同一段时间内,用不同物质来表示该反应的化学反应速率,当单位相同时,化学反应速率的数值之比等于这些物质在化学方程式中的⑥化学计量数之比。即v(A)∶v(B)∶v(C)
