
电位滴定法(课堂PPT).ppt

知识****SA







亲,该文档总共27页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

电位滴定法(课堂PPT).ppt
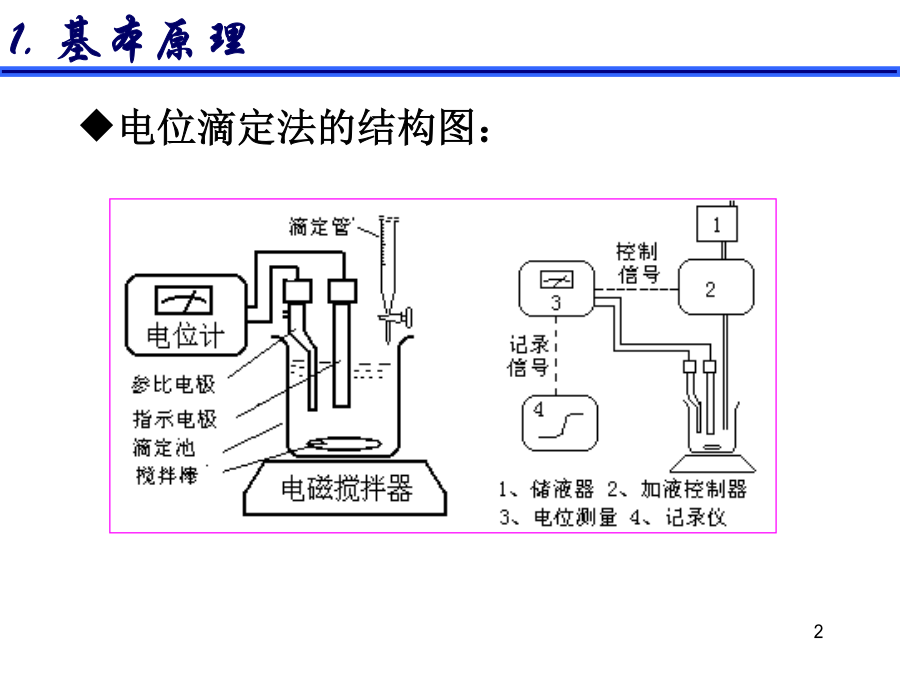
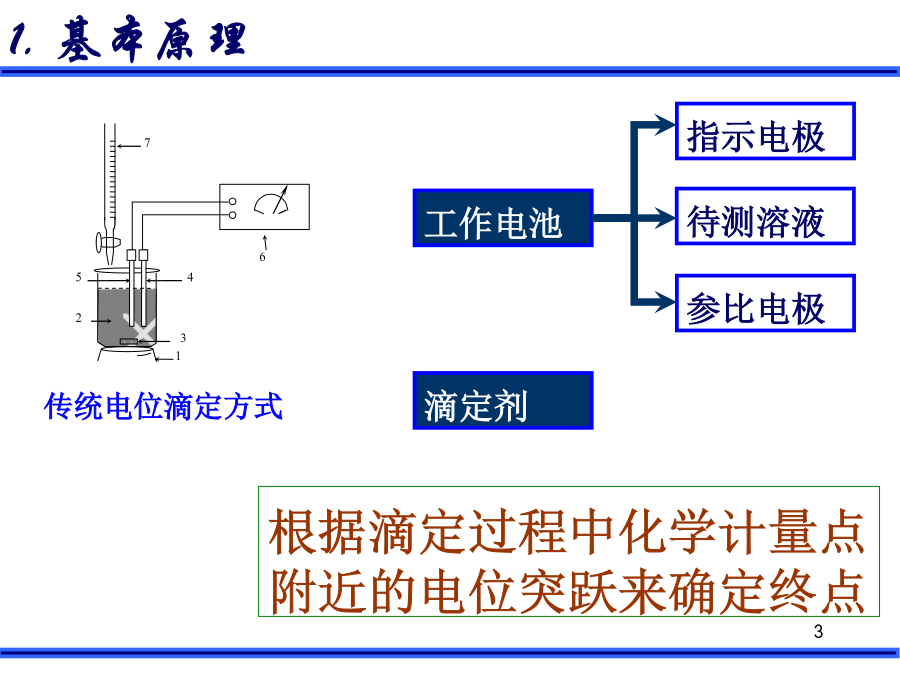
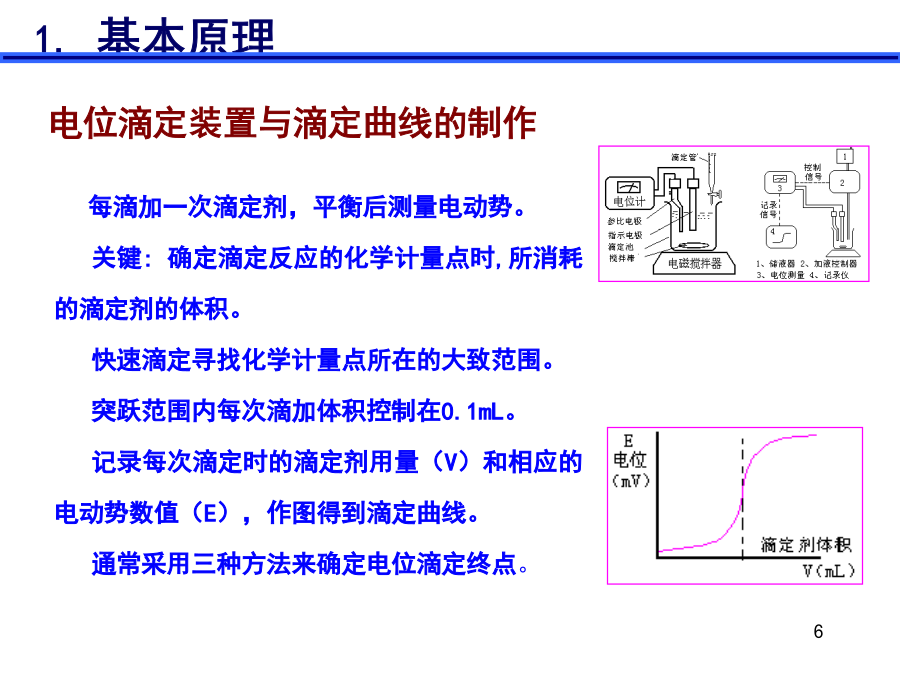
电位滴定法的结构图:电位滴定装置与滴定曲线的制作2.电位终点的确定(2)绘(△E/△V)-V曲线法△E/△V为E的变化值与相对应的加入滴定剂的体积的增量的比。曲线上存在着极值点该点对应着E-V曲线中的拐点(3)二级微商法(4)滴定终点确定方法:图解法(E-V曲线法):一般的滴定曲线,横坐标为滴定剂的体积,纵坐标为指示电极电位值(或电池电动势),滴定终点为曲线的拐点;(b)一阶微商法(极值点):又称微分滴定曲线,纵坐标改为ΔΕ/ΔV,曲线出现极大值,极大值指示的体积就是滴定的终点;(c)二阶微商法(等于零点

电位滴定法(课堂PPT).ppt
电位滴定法的结构图:电位滴定装置与滴定曲线的制作2.电位终点的确定(2)绘(△E/△V)-V曲线法△E/△V为E的变化值与相对应的加入滴定剂的体积的增量的比。曲线上存在着极值点该点对应着E-V曲线中的拐点(3)二级微商法(4)滴定终点确定方法:图解法(E-V曲线法):一般的滴定曲线,横坐标为滴定剂的体积,纵坐标为指示电极电位值(或电池电动势),滴定终点为曲线的拐点;(b)一阶微商法(极值点):又称微分滴定曲线,纵坐标改为ΔΕ/ΔV,曲线出现极大值,极大值指示的体积就是滴定的终点;(c)二阶微商法(等于零点

电位滴定法.pptx
电位滴定法目录电位滴定法实验目的实验原理电位滴定法的电极根据滴定反应的类型,只要有合适的指示电极和参比电极,电位滴定法可用于各类滴定分析。电位滴定法的操作滴定终点的确定电位滴定法的特点电位滴法优缺点电位滴定法测定DL苹果酸(2010版药典)【标定】:氢氧化钠滴定液(0.1mol/l):取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.6g,标定。每1ml氢氧化钠滴定液(0.1ml/l)相当于20.42mg的邻苯二甲酸氢钾样品:DL苹果酸四.实验步骤1)仪器准备,参照ZDJ-5型自动滴定仪说明书2)参数设置3

电位滴定法.pdf

电位滴定法测亚铁离子含量ppt课件.ppt
基本单元训练职业关键能力:获得新知识的能力;学习中能提出不同见解的能力;工作中提出多种解决问题的思路。知识目标:学习氧化还原滴定法的原理与实验方法,各种滴定终点确定方法(V~E曲线法、一阶微商法与二阶微商法)。专门技能:在规定的时间内,完成运用电位滴定法测定硫酸亚铁铵溶液中Fe2+含量,熟练准确地确定电位滴定终点。素质目标:培养学生团队协作精神,培养学生对所做实验结果进行自我评价的能力,遵守实验室各项规章制度。问题电位滴定法电位滴定法电位滴定装置学生实训操作实训小结E~V曲线法一阶微商法二阶微商法(作图法
