
《无机化学》第7章化学键理论与分子结构.ppt

和蔼****娘子








亲,该文档总共110页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

《无机化学》第7章化学键理论与分子结构.ppt
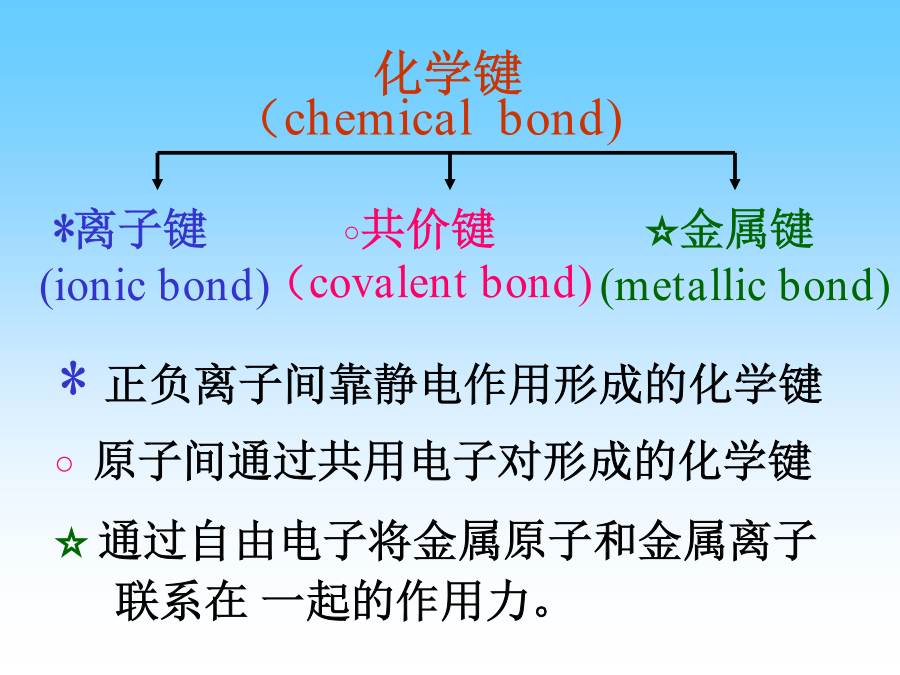
化学键理论和分子结构●原子间的结合方式及结合力(化学键)﹡正负离子间靠静电作用形成的化学键化学键理论原子化学键分子晶体类型2H共价键分子间力H2O(l)H2O(s)分子晶体ONa→Na+离子键Na+Cl-(s)离子晶体Cl→Cl-共价键CC(金刚石)原子晶体金属键NaNa(s)金属晶体化学键Lewis的经典共价理论:1927年海特勒(Heitler)和伦敦(London)用量子力学处理H2分子结构,提示了共价键的本质。(一)氢分子的形成:(一)氢分子的形成r(pm)n=1,l=0,m=0,ms=+1/2n

无机化学 化学键与分子结构.ppt
无机化学为什么要讨论分子的内部结构?离子键理论19164.1.1离子键的形成4.1.2离子键特点4.1.3离子特征4.1.4离子晶体4.1.5晶格能离子型化合物:活泼金属原子与活泼非金属原子所形成的化合物。如KCl,CaO等。原子间发生电子转移而形成具有稳定结构的正负离子,当正、负离子的吸引和排斥力达到平衡时形成离子键。(2)离子键的形成条件4.1.2离子键特点离子键和共价键之间,并非可以截然区分的,可将离子键视为极性共价键的一个极端,另一极端为非极性共价键。AB型化合物单键的离子性百分数与电负性差值之间

化学键与分子结构-无机化学.ppt
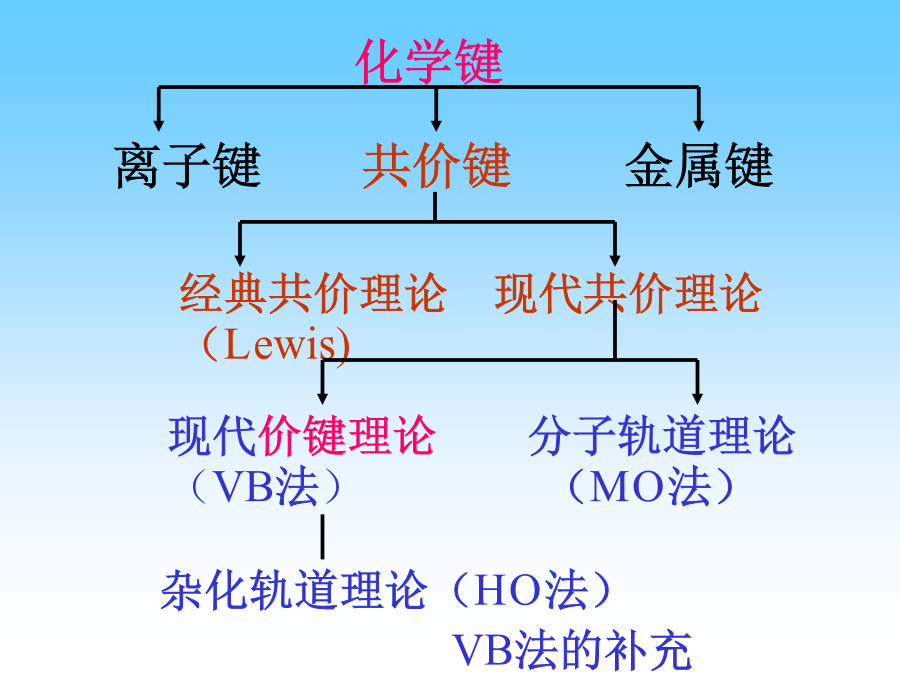
化学键6.1离子键6.1.1离子键的形成条件离子键和共价键之间,并非可以截然区分的,可将离子键视为极性共价键的一个极端,另一极端为非极性共价键。6.1.2离子键的强度6.1.3离子键的特点思考:在氯化钠晶体中,在Na+(或Cl-)周围只排列着6个相反的Cl-(或Na+),是否不符合离子键无饱和性的特点?6.1.4离子的特征离子电荷离子半径离子半径变化规律离子半径变化规律离子的电子构型⑤9-17电子构型,如6.2共价键理论Lewis共价学说练习:写出HNO3、CO32–和SO42–的Lewis结构式。6.2

简明无机化学化学键和分子结构课件.ppt
第六章化学键和分子结构20世纪30年代前后,量子力学理论的建立及其在化学领域的应用,使得化学键理论及分子结构的研究工作得到飞速发展。6.1离子键理论6.1.1离子键的形成相应的电子构型变化为3s23p53s23p6根据得失电子的个数,可以确定离子化合物中元素的化合价。第二步靠静电吸引,形成化学键。体系的势能与核间距之间的关系如图所示:VV下面来考察Na+和Cl-彼此接近的过程中,势能V的变化。VVVV因此,离子相互吸引,并保持一定距离r0时,体系最稳定。这就意味着形成了离子键。2.离子键的形成条件>1

“无机化学”中“化学键与分子结构”一章的教学探讨.docx
“无机化学”中“化学键与分子结构”一章的教学探讨化学键是无机化学中重要的概念之一,它决定了分子的结构和化学性质。本文将以《无机化学》中“化学键与分子结构”一章为基础,探讨无机化学中化学键与分子结构的教学方法和策略。第一,注重理论与实践结合。无机化学是一门既重理论又重实验的学科,理论知识和实验操作在教学中缺一不可。教师可以通过讲授理论知识,如电子排布、价层电子和由化学键形成的分子结构等,来帮助学生建立起相关的概念和基础。同时,教师还应当进行实验演示,让学生亲手操作和观察化学反应,从而深入理解化学键和分子结构
