
(全国通用版)2022版高考化学一轮复习 第5章 物质结构元素周期律 2 元素周期表元素周期律课时作业(含解析).doc

星星****眨眼










在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

(全国通用版)2022版高考化学一轮复习 第5章 物质结构元素周期律 2 元素周期表元素周期律课时作业(含解析).doc
元素周期表元素周期律(45分钟100分)一、选择题(本题包括12小题,每题5分,共60分)1.门捷列夫对化学这一学科发展最大贡献在于发现了化学元素周期律。下列事实不能用元素周期律解释的有()A.碱性:KOH>Ca(OH)2>Mg(OH)2B.稳定性:H2O>H2S>H2SeC.挥发性:HNO3>H3PO4>H2SO4D.原子半径:P>S>Cl【解析】选C。元素的金属性越强,其原子失电子能力越强,其对应最高价氧化物的水化物碱性越强,金属性:K>Ca>Mg,则碱性:KOH>Ca(OH)2>Mg(OH)2,A可

(全国通用版)2022版高考化学一轮复习课时梯级作业:第5章 物质结构元素周期律 5-2 元素周期表元素周期律 WORD版含解析.doc
课时梯级作业十六元素周期表元素周期律(45分钟100分)一、选择题(本题包括12小题,每题5分,共60分)1.门捷列夫对化学这一学科发展最大贡献在于发现了化学元素周期律。下列事实不能用元素周期律解释的有()A.碱性:KOH>Ca(OH)2>Mg(OH)2B.稳定性:H2O>H2S>H2SeC.挥发性:HNO3>H3PO4>H2SO4D.原子半径:P>S>Cl【解析】选C。元素的金属性越强,其原子失电子能力越强,其对应最高价氧化物的水化物碱性越强,金属性:K>Ca>Mg,则碱性:KOH>Ca(OH)2>Mg

(全国通用版)2022版高考化学一轮复习 第5章 物质结构元素周期律 1 原子结构化学键课时作业(含解析).doc
原子结构化学键(45分钟100分)一、选择题(本题包括7小题,每题6分,共42分)1.1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界不存在的磷元素的一种同位素P):,开创了人造核素的先河。下列有关说法不正确的是()A.该变化说明原子核在一般的化学反应中也能发生变化B.该变化同样遵循质量守恒定律Cn是一种电中性粒子D.对于P有:原子序数=质子数=中子数=核外电子数【解析】选A。化学反应中原子核是不变的,只有核反应中原子核才发生变化,核反应也遵守质量守恒定律n代表中子,是电中性粒子P中,原子序

(全国通用)2021高考化学一轮复习 第5章 物质结构 元素周期律 第2节 元素周期表和元素周期律课时作业(含解析).doc
第2节元素周期表和元素周期律时间:45分钟满分:100分一、选择题(每题6分,共72分)1.下列有关元素的性质或递变规律的说法正确的是()A.第ⅠA族与第ⅦA族元素间可形成共价化合物或离子化合物B.第三周期主族元素从左到右,氧化物对应的水化物酸性依次增强C.同主族元素的简单阴离子还原性越强,对应的简单氢化物沸点越高D.同周期金属元素的主族序数越大,其原子失电子能力越强答案A解析第ⅠA族为H和碱金属元素,第ⅦA族元素为卤族元素,H与卤族元素形成共价化合物,碱金属元素与卤族元素形成离子化合物,A正确;第三周期
(通用版)2019版高考化学一轮复习 第五章 物质结构 元素周期律 第2节 元素周期表 元素周期律学案 新人教版.doc
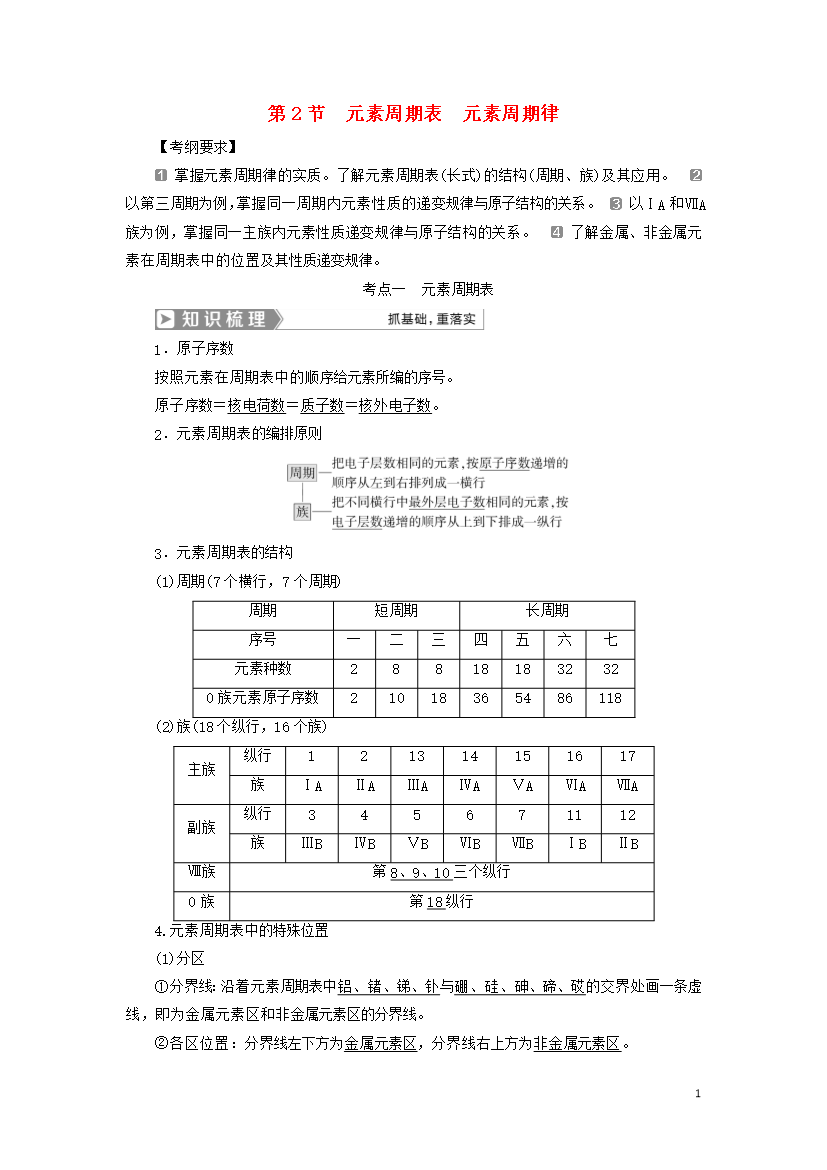
17第2节元素周期表元素周期律【考纲要求】掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。以第三周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。了解金属、非金属元素在周期表中的位置及其性质递变规律。考点一元素周期表1.原子序数按照元素在周期表中的顺序给元素所编的序号。原子序数=核电荷数=质子数=核外电子数。2.元素周期表的编排原则3.元素周期表的结构(1)周期(7个横行,7个周期)周期短周期长周期序号一
