
高考化学模拟考试卷(附带答案解析).pdf

文库****品店









亲,该文档总共16页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

高考化学模拟考试卷(附带答案解析).pdf
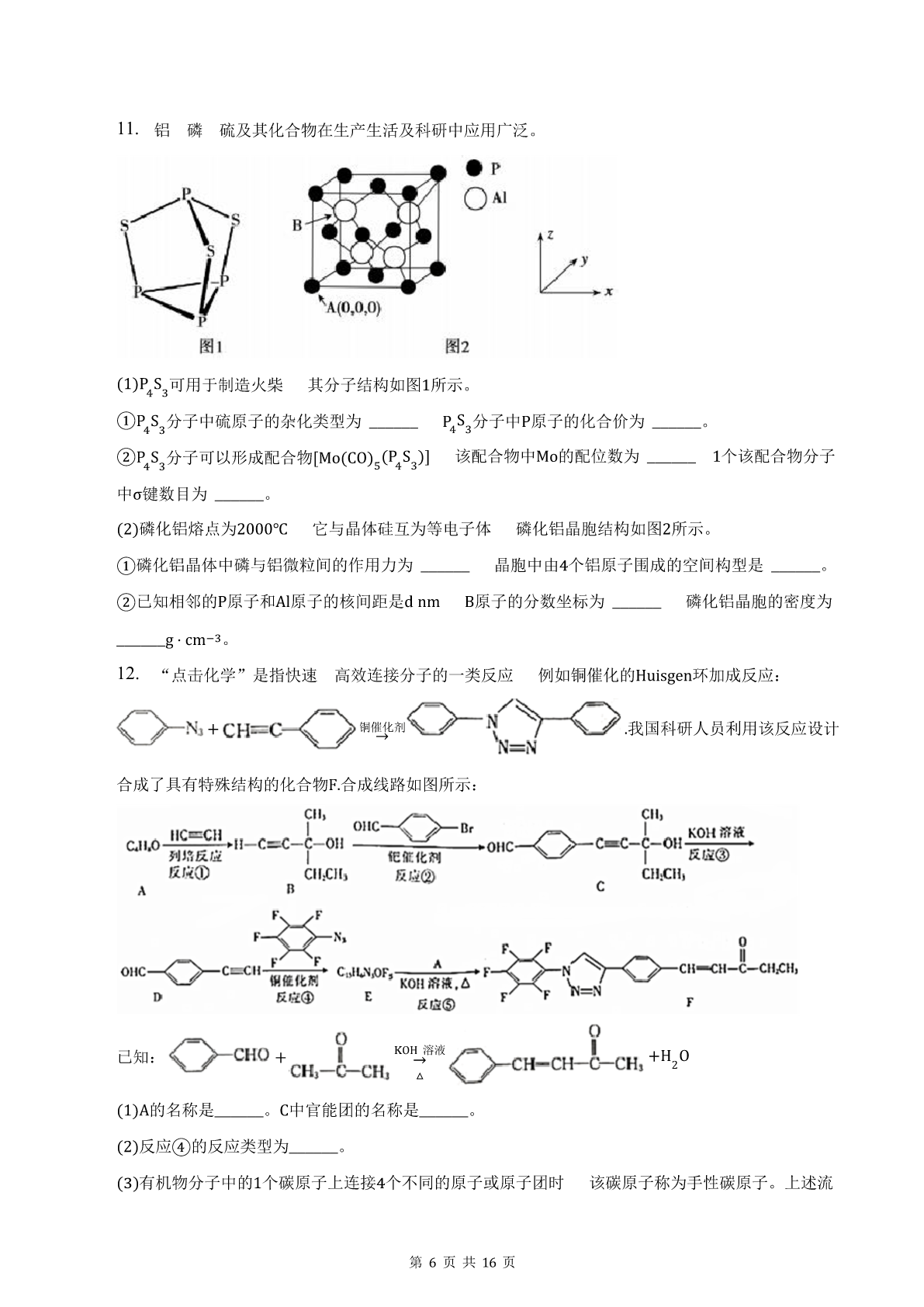
高考化学模拟考试卷(附带答案解析)一单选题(本大题共7小题共42.0分)1.《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属……晒干烧灰以原水淋汁…久则凝淀如石……浣衣发面甚获利也。”下列说法中错误的是()A.“石碱”可用作洗涤剂B.“石碱”的主要成分易溶于水C.“石碱”俗称烧碱D.“久则凝淀如石”的操作为结晶2.下列关于烃的性质的说法中正确的是()A.苯和甲苯都能与硝酸发生苯环上的取代反应B.苯和甲苯使酸性高锰酸钾溶液褪色C.苯和己炔都能使溴的四氯化碳溶液褪色D.苯和乙烷与卤素单质发生取代反应都需要铁作

高考化学模拟考试卷(附带答案解析).pdf
高考化学模拟试卷(附带答案解析).pdf
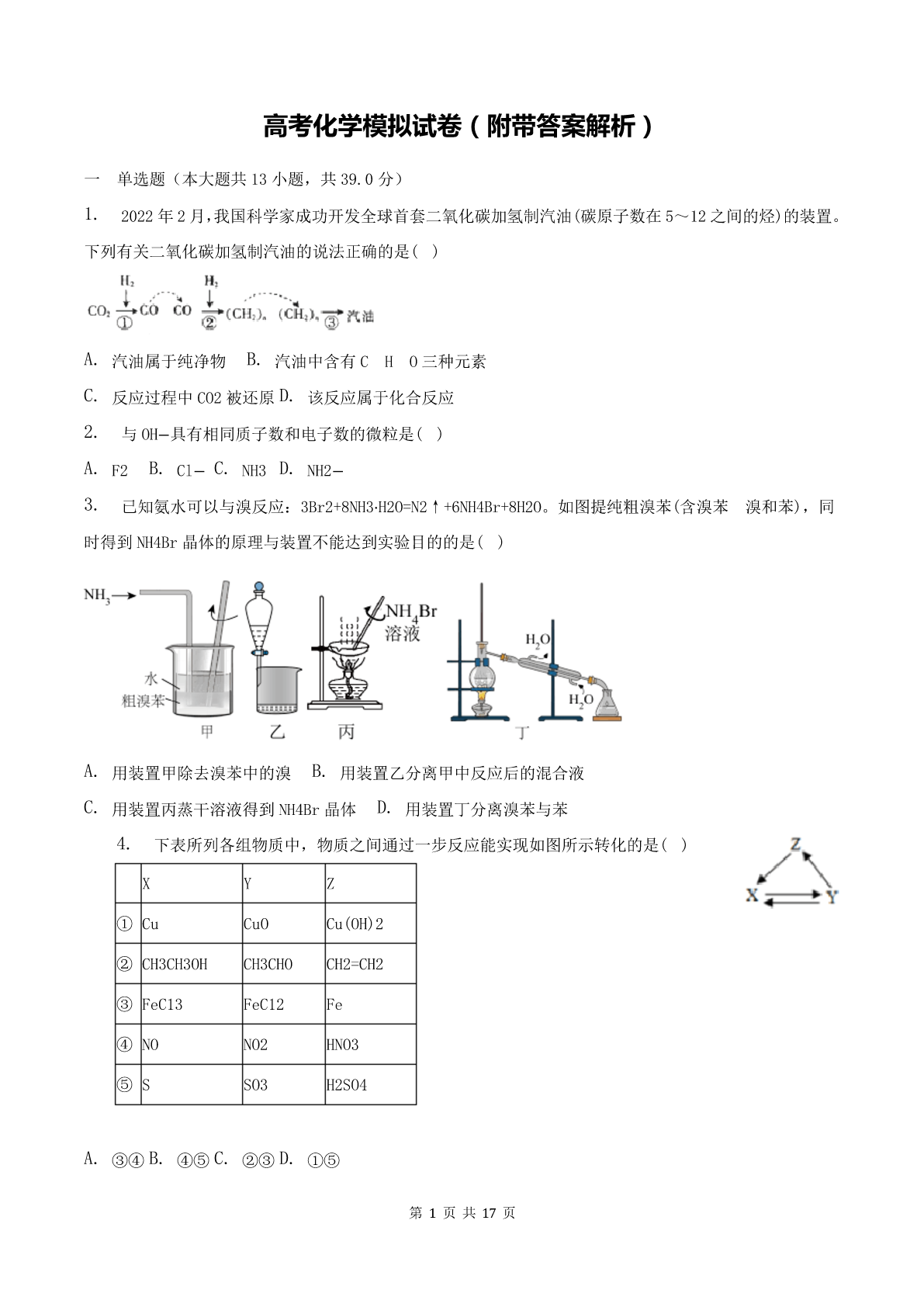
高考化学模拟试卷(附带答案解析)一单选题(本大题共13小题,共39.0分)1.2022年2月,我国科学家成功开发全球首套二氧化碳加氢制汽油(碳原子数在5~12之间的烃)的装置。下列有关二氧化碳加氢制汽油的说法正确的是()A.汽油属于纯净物B.汽油中含有CHO三种元素C.反应过程中CO2被还原D.该反应属于化合反应2.与OH−具有相同质子数和电子数的微粒是()A.F2B.Cl−C.NH3D.NH2−3.已知氨水可以与溴反应:3Br2+8NH3⋅H2O=N2↑+6NH4Br+8H2O。如图提纯粗溴苯(含溴苯溴

高考化学模拟试卷(附带答案解析).pdf
高考地理模拟考试卷(附带答案解析).pdf
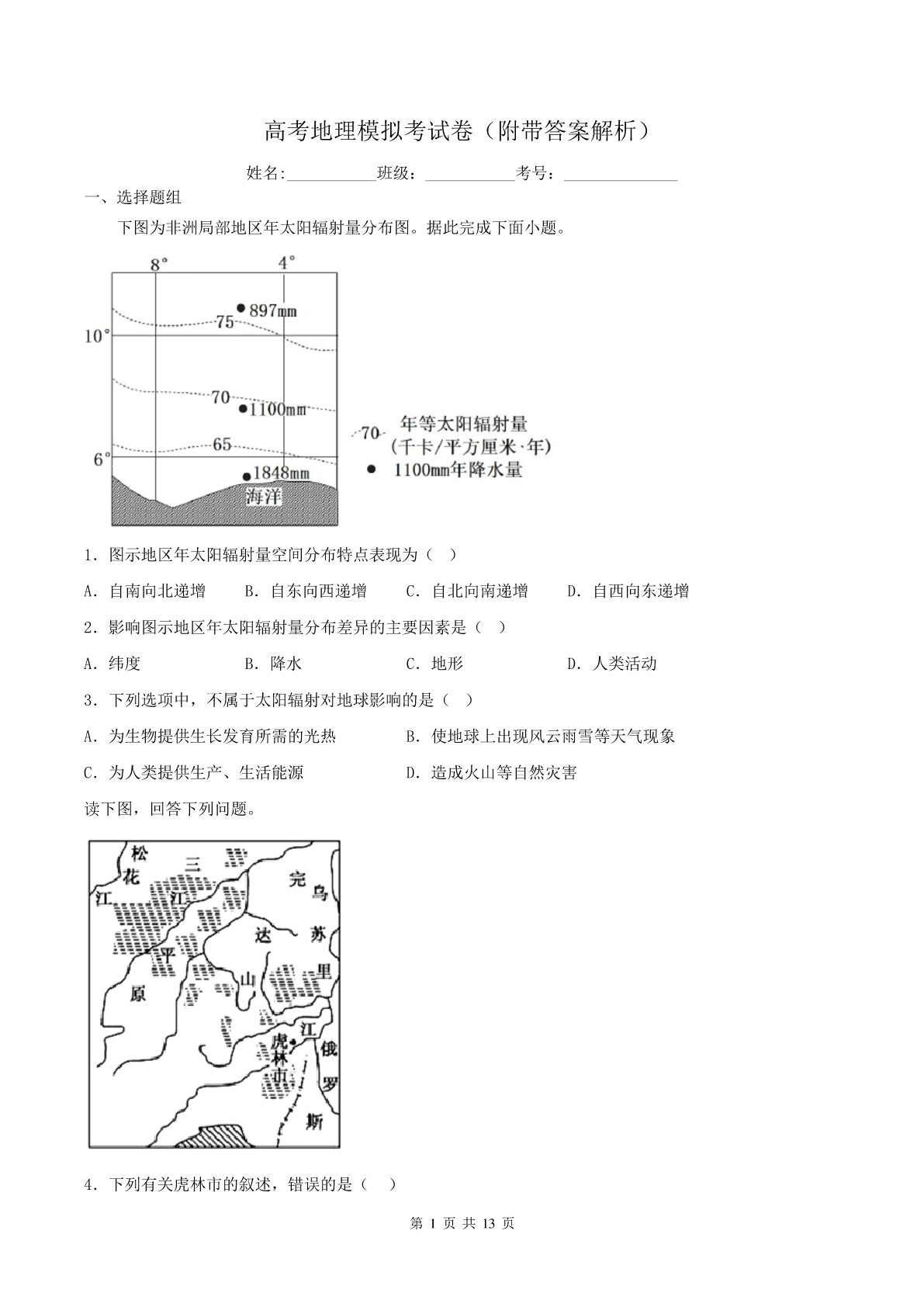
高考地理模拟考试卷(附带答案解析)姓名:___________班级:___________考号:______________一、选择题组下图为非洲局部地区年太阳辐射量分布图。据此完成下面小题。1.图示地区年太阳辐射量空间分布特点表现为()A.自南向北递增B.自东向西递增C.自北向南递增D.自西向东递增2.影响图示地区年太阳辐射量分布差异的主要因素是()A.纬度B.降水C.地形D.人类活动3.下列选项中,不属于太阳辐射对地球影响的是()A.为生物提供生长发育所需的光热B.使地球上出现风云雨雪等天气现象C.为
