
试题-全国-2010_八年级自然科学质量守恒和物质之间的转化鄂教版知识精讲.rar

An****99








在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

试题-全国-2010_八年级自然科学质量守恒和物质之间的转化鄂教版知识精讲.rar
初二自然科学质量守恒和物质之间的转化鄂教版【本讲教育信息】一.教学内容:质量守恒和物质之间的转化二.学习目标:1、理解质量守恒定律;运用质量守恒定律解释生活中的现象;2、能根据质量守恒定律和实验事实正确读写常见、重要的化学方程式。(重点)3、在理解化学方程式含义的基础上,能用常见的化学方程式或给定化学方程式进行有关反应物、生成物质量的简单计算。(重点、难点)4、掌握金属、金属氧化物、碱之间的互相转化关系以及非金属、非金属氧化物、酸之间的互相转化关系。三.重难点讲解:【知识点1】质量守恒定律1、定义:参加反

八年级自然科学质量守恒和物质之间的转化鄂教版知识精讲 试题.doc
初二自然科学质量守恒和物质之间的转化鄂教版【本讲教育信息】一.教学内容:质量守恒和物质之间的转化二.学习目标:1、理解质量守恒定律;运用质量守恒定律解释生活中的现象;2、能根据质量守恒定律和实验事实正确读写常见、重要的化学方程式。(重点)3、在理解化学方程式含义的基础上,能用常见的化学方程式或给定化学方程式进行有关反应物、生成物质量的简单计算。(重点、难点)4、掌握金属、金属氧化物、碱之间的互相转化关系以及非金属、非金属氧化物、酸之间的互相转化关系。三.重难点讲解:【知识点1】质量守恒定律1、定义:参加反

八年级自然科学质量守恒和物质之间的转化鄂教版知识精讲.rar
初二自然科学质量守恒和物质之间的转化鄂教版【本讲教育信息】一.教学内容:质量守恒和物质之间的转化二.学习目标:1、理解质量守恒定律;运用质量守恒定律解释生活中的现象;2、能根据质量守恒定律和实验事实正确读写常见、重要的化学方程式。(重点)3、在理解化学方程式含义的基础上,能用常见的化学方程式或给定化学方程式进行有关反应物、生成物质量的简单计算。(重点、难点)4、掌握金属、金属氧化物、碱之间的互相转化关系以及非金属、非金属氧化物、酸之间的互相转化关系。三.重难点讲解:【知识点1】质量守恒定律1、定义:参加反
试题-全国-2009_初三自然科学物质的分离及转化鄂教版知识精讲.rar
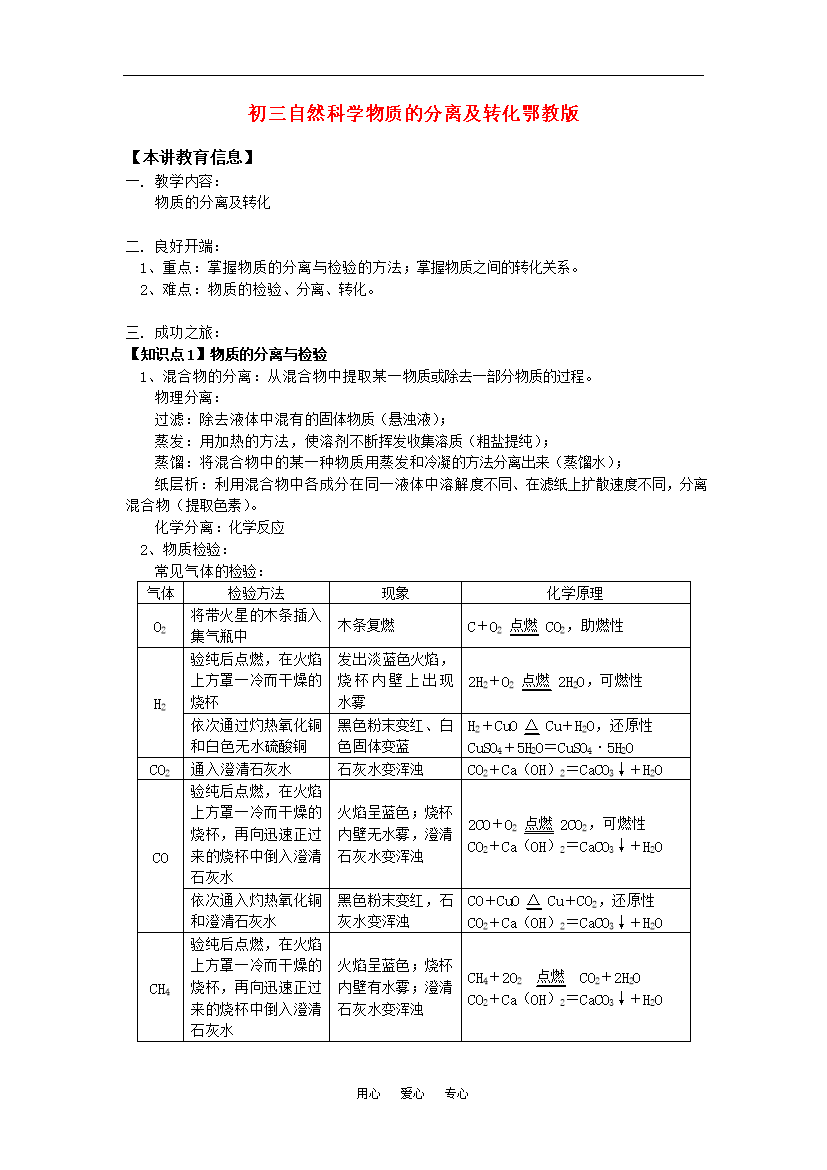
用心爱心专心初三自然科学物质的分离及转化鄂教版【本讲教育信息】一.教学内容:物质的分离及转化二.良好开端:1、重点:掌握物质的分离与检验的方法;掌握物质之间的转化关系。2、难点:物质的检验、分离、转化。三.成功之旅:【知识点1】物质的分离与检验1、混合物的分离:从混合物中提取某一物质或除去一部分物质的过程。物理分离:过滤:除去液体中混有的固体物质(悬浊液);蒸发:用加热的方法,使溶剂不断挥发收集溶质(粗盐提纯);蒸馏:将混合物中的某一种物质用蒸发和冷凝的方法分

初三自然科学物质的分离及转化鄂教版知识精讲.doc
初三自然科学物质的分离及转化鄂教版【本讲教育信息】一.教学内容:物质的分离及转化二.良好开端:1、重点:掌握物质的分离与检验的方法;掌握物质之间的转化关系。2、难点:物质的检验、分离、转化。三.成功之旅:【知识点1】物质的分离与检验1、混合物的分离:从混合物中提取某一物质或除去一部分物质的过程。物理分离:过滤:除去液体中混有的固体物质(悬浊液);蒸发:用加热的方法使溶剂不断挥发收集溶质(粗盐提纯);蒸馏:将混合物中的某一种物质用蒸发和冷凝的方法分离出来(蒸馏水);纸层
