
一种奥美沙坦酯中间体杂质合成、鉴定的方法.pdf

努力****向丝










亲,该文档总共12页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

一种奥美沙坦酯中间体杂质合成、鉴定的方法.pdf
本发明涉及医药领域,具体涉及一种奥美沙坦酯中间体杂质合成、鉴定的方法。制备奥美沙坦酯起始原料A[4‑(1‑羟基‑1‑甲基乙基)‑2‑丙基咪唑‑5‑羧酸乙酯过程中引入杂质C(4‑乙酰基‑2‑丙基咪唑‑5‑羧酸乙酯),以杂质C为原料,与起始物料B{4‑[2‑(三苯甲基四唑‑5‑基)苯基]苄基溴)}反应得到同分异构体杂质D和杂质E并分离提纯,确认杂质D和杂质E在中间体I中残留,通过

奥美沙坦酯关键中间体的合成工艺改进.docx
奥美沙坦酯关键中间体的合成工艺改进奥美沙坦酯是一种常用的治疗高血压和心血管疾病的药物,它属于安格Ⅱ受体拮抗剂类药物。其关键中间体的合成工艺对于大规模生产和药物质量的稳定性非常重要。本文将探讨奥美沙坦酯关键中间体的合成工艺改进,以提高合成效率和药物质量。当前奥美沙坦酯的生产工艺主要分为以下几个步骤:首先是对苯醌进行改性,生成关键中间体2-氨基-3-甲氧基-5-(3-苯基-2-异异丙基)苯甲酰胺(AMOP)或其硫醇衍生物。随后,AMOP与4-(二甲氨基)丁酸酯加热反应得到目标产物奥美沙坦酯。为了改进这一合成工

一种奥美沙坦酯中间体的制备方法.pdf
本发明提供了一种奥美沙坦酯中间体4‑氯甲基‑5‑甲基‑1,3‑二氧杂环戊烯‑2‑酮的制备方法,从起始原料4,5‑二甲基‑1,3‑二氧杂环戊烯‑2‑酮出发,通过使用三氯异氰尿酸进行氯代反应、高温下进行重排反应、使用甲叔醚和正庚烷结晶纯化三步工序,以高收率制备得到高纯度的4‑氯甲基‑5‑甲基‑1,3‑二氧杂环戊烯‑2‑酮。
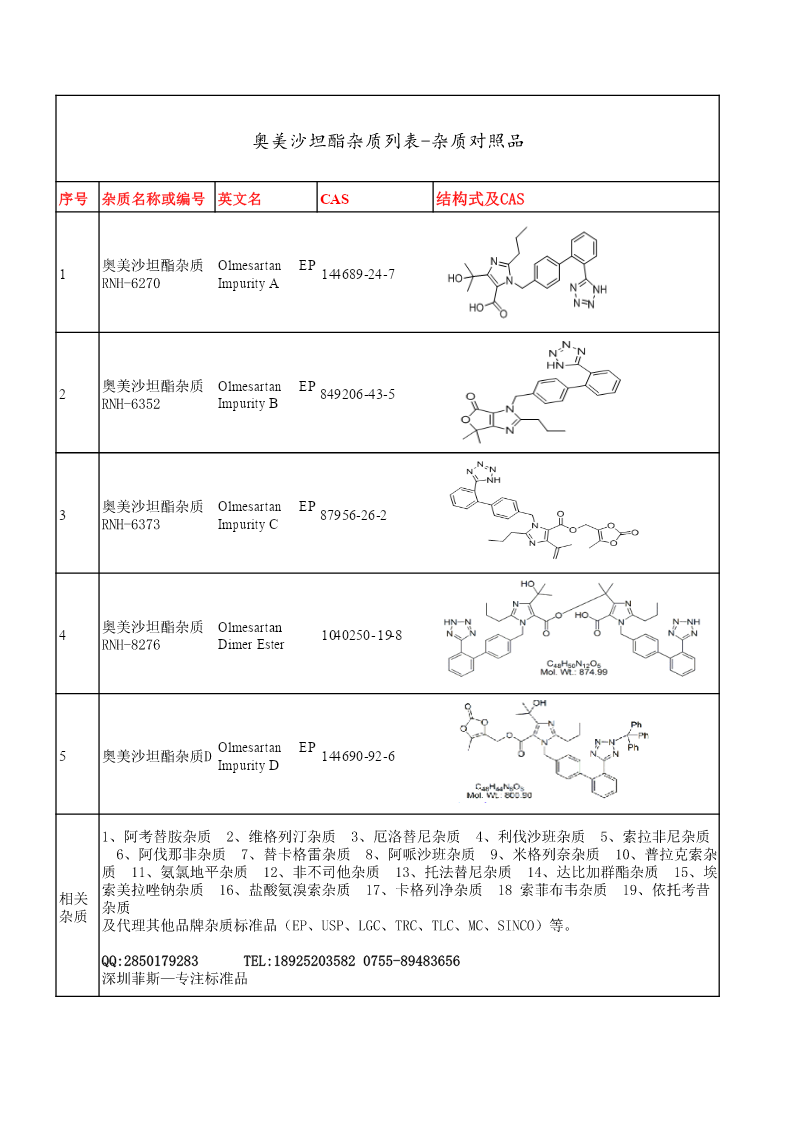
奥美沙坦酯杂质列表-杂质对照品.pdf
奥美沙坦酯杂质列表-杂质对照品序号杂质名称或编号英文名CAS结构式及CAS奥美沙坦酯杂质OlmesartanEP1144689-24-7RNH-6270ImpurityA奥美沙坦酯杂质OlmesartanEP2849206-43-5RNH-6352ImpurityB奥美沙坦酯杂质OlmesartanEP387956-26-2RNH-6373ImpurityC奥美沙坦酯杂质Olmesartan41040250-19-8RNH-8276DimerEsterOlmesartanEP5奥美沙坦酯杂质D144690

一种连续流制备奥美沙坦酯中间体的合成方法.pdf
本发明公开了一种连续流制备奥美沙坦酯中间体合成方法,属于药物合成技术领域,包括下列步骤:步骤(1),将式I化合物2‑丙基‑4,5‑咪唑二羧酸乙酯I溶解于有机溶剂中行成反应相A,步骤(2),将商业化购买的甲基氯化镁溶液作为反应相B,步骤(3),将反应相A和反应相B用柱塞泵以一定流速泵入混合器中,然后进入反应器,保留一定时间后,用酸水相C淬灭,并进入油水连续分液器,进行分液,即得化合物式II的有机溶液,脱溶后重结晶可得式II化合物,解决了现有制作过程纯度低、成本高的技术问题,本发明产品纯度高,杂质少,关键杂质
