
初中化学酸碱盐性质之酸的通性总结.doc

my****25










在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

初中化学酸碱盐性质之酸的通性总结.doc
初中化学酸碱盐性质之酸的通性总结来源:网络资源|作者:未知|本文已影响1932人酸的组成——氢离子+酸根离子(1)跟指示剂反应紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色(2)酸的PH<7(3)跟(H)前的活泼金属起置换反应酸+金属==盐+氢气例:2HCl+Fe=FeCl2+H2↑(4)跟碱性氧化物和某些金属氧化物反应酸+碱性(金属)氧化物—→盐+水例:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O(5)跟某些盐反应酸+碳酸盐==盐+水酸+盐—→新酸+新盐例:H2SO4+BaCl2=2HCl+Ba

酸碱盐性质之酸的通性.doc
酸碱盐性质之酸的通性本文由查字典化学网为您整理提供:酸的组成——氢离子+酸根离子(1)跟指示剂反应紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色(2)酸的PH<7(3)跟(H)前的活泼金属起置换反应酸+金属==盐+氢气例:2HCl+Fe=FeCl2+H2↑(4)跟碱性氧化物和某些金属氧化物反应酸+碱性(金属)氧化物—→盐+水例:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O(5)跟某些盐反应酸+碳酸盐==盐+水酸+盐—→新酸+新盐例:H

酸碱盐的性质和通性.doc
酸碱盐的性质和通性酸的性质(1)酸+碱=盐+水即:中和反应。反应条件:无反应类型:复分解反应例:H2SO4(酸)+Mg(OH)2(碱)=MgSO4(盐)+2H2O(水)(2)酸+盐=新酸+新盐反应条件:1.有气体或者水或者沉淀生成才能反应2.盐必须溶于酸:例如BaSO4、AgCl不能与酸反应,因为它不溶于酸(初中化学不讨论)反应类型:复分解反应例:2HCI(酸)+Na2CO3(盐)=H2CO3(新酸)+2NaCl(新盐)但是碳酸不稳定:H2CO3=H2O+CO2↑这样就有气体和水生成了(3)酸+活泼金属=
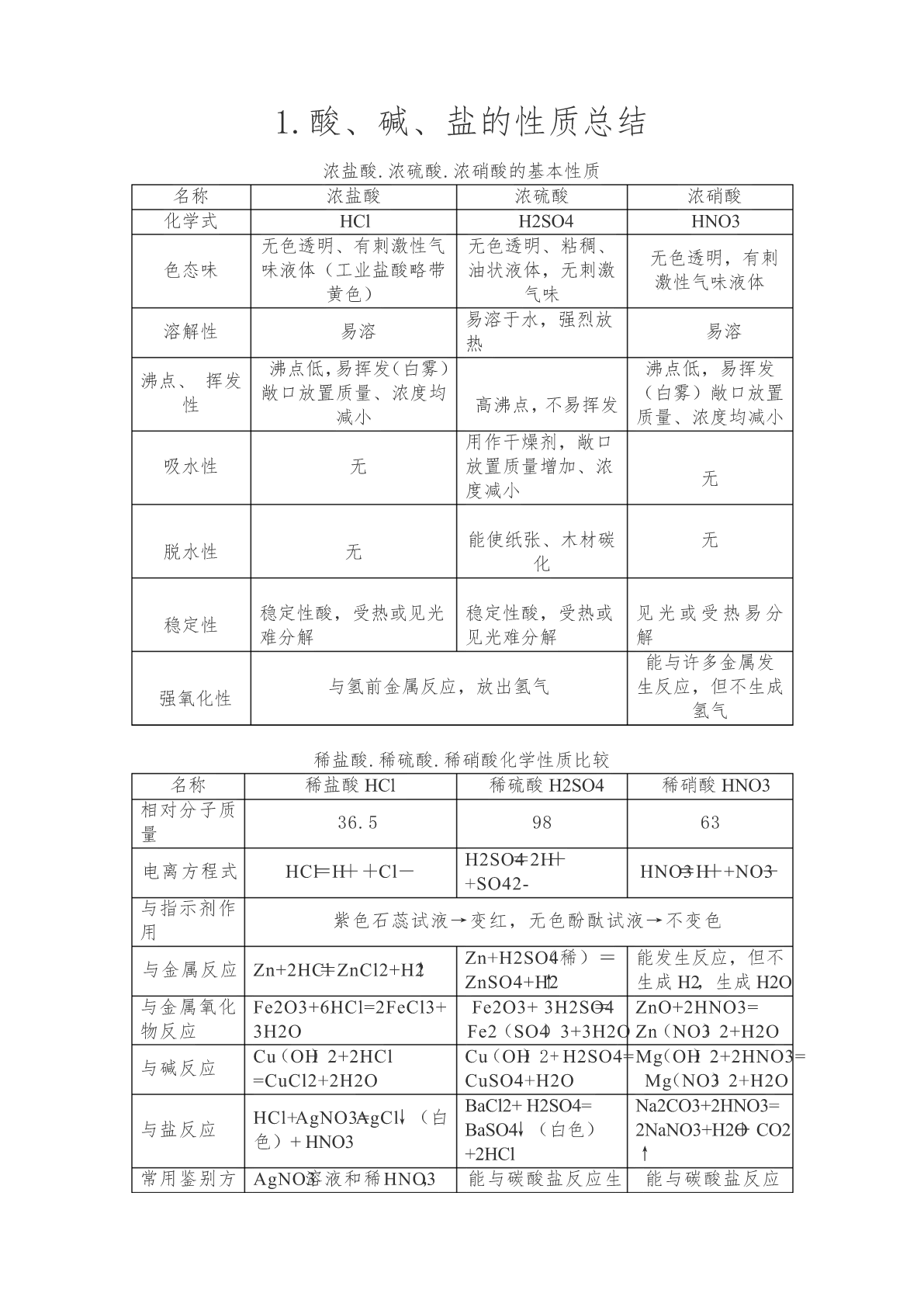
初中化学酸碱盐性质总结.pdf
1.酸、碱、盐的性质总结浓盐酸.浓硫酸.浓硝酸的基本性质名称浓盐酸浓硫酸浓硝酸化学式HClH2SO4HNO3无色透明、有刺激性气无色透明、粘稠、无色透明,有刺色态味味液体(工业盐酸略带油状液体,无刺激激性气味液体黄色)气味易溶于水,强烈放溶解性易溶易溶热沸点低,易挥发(白雾)沸点低,易挥发沸点、挥发敞口放置质量、浓度均(白雾)敞口放置性高沸点,不易挥发减小质量、浓度均减小用作干燥剂,敞口吸水性无放置质量增加、浓无度减小能使纸张、木材碳无脱水性无化稳定性酸,受热或见光稳定性酸,受热或见光或受热易分稳定性难分

酸碱盐的通性.doc
酸碱盐的性质酸的通性1、与酸碱指示剂的反应。使紫色石蕊试液变红,无色酚酞不变色。2、酸+金属=盐+氢气。该金属必须是排在H前面的且K、Ca、Na除外,(要求掌握H2SO4和HCl。)H2SO4+Zn=ZnSO4+H2↑3、酸+金属氧化物=盐+水。可以是所有的金属氧化物,(要求掌握H2SO4和HCl。)H2SO4+CuO=CuSO4+H2O4、酸+碱=盐+水。只要是酸遇到碱,不论是哪一种酸哪一种碱,一定会发生此类反应。HCl+NaOH=NaCl+H2O5、酸+盐=新盐+新酸。只能是强酸生成弱酸。H2SO4+
