
催化反应动力学别构反应全解.ppt

YY****。。









亲,该文档总共65页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

催化反应动力学别构反应全解.ppt
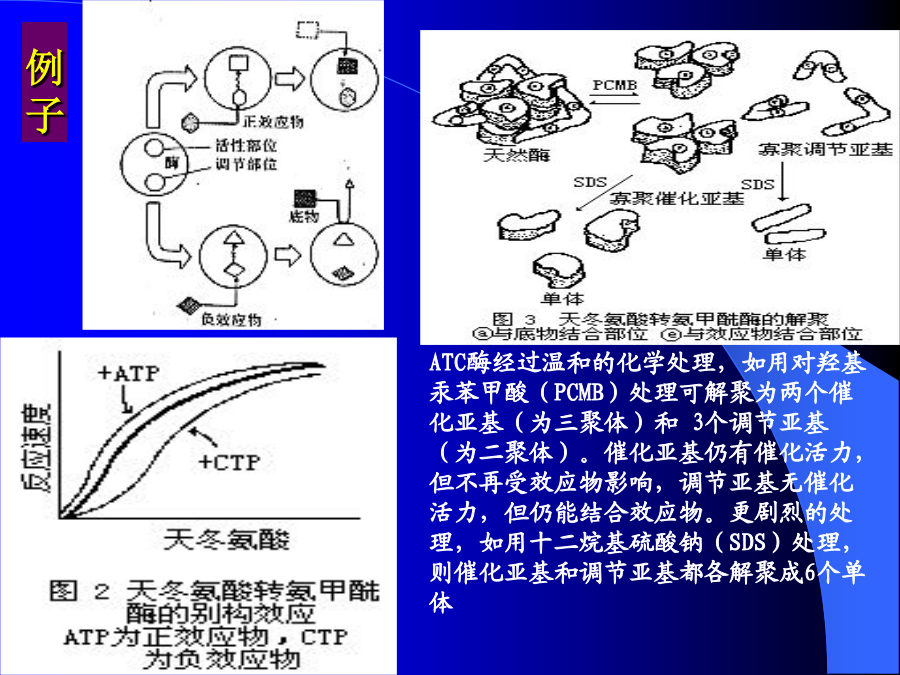
酶学第一节单底物反应动力学第二节抑制作用动力学第三节多底物反应动力学第四节别构酶动力学第五节pH和温度对酶催化反应速度的影响第四节别构酶反应动力学例子主要内容一、配体(底物)与蛋白质结合中协同效应(二)配体与蛋白质结合2、与具多个结合部位的蛋白质结合Hill方程例:血红蛋白Hill系数虽与实验数据有偏,但此方程很好地适合了血红蛋白氧合曲线及其它别构蛋白的协同过程,因此其数据处理方法即Lg(Y/(1-Y))~lgPO2作图法(Hill作图法)得到应用。血红蛋白氧合具高协同性,因此极高或极低氧下只结合一个氧分

酶催化反应动力学.docx
第3章酶催化反应动力学(2学时)主要内容:3.1酶催化反应速度3.2底物浓度对酶促反应速度的影响3.3抑制剂对酶促反应速度的影响3.4其它因素对酶促反应速度的影响酶催化反应动力学也称酶促反应动力学(kineticsofenzyme-catalyzedreactions),是研究酶促反应速度以及影响此速度的各种因素的科学。在研究酶的结构与功能的关系以及酶的作用机制时,需要酶促反应动力学提供相关的实验证据;为了找到最有利的反应条件从而提高酶催化反应的效率以及了解酶在代谢过程中的作用和某些药物的作用机制等,也需

酶催化反应动力学.pptx
会计学1.1酶催化反应概论降低反应的活化能,加快生化反应的速率;但不改变反应的方向和平衡关系;不能改变反应的平衡常数,而只能加快反应达到平衡的速率。酶的催化特性高效的催化活性强的专一性酶反应需要辅因子的参与酶易变性与失活酶反应的特性1.1.2酶的催化反应机制1.1.2.2酶反应的专一性机制1.1.2.3酶反应的高效性机制酶催化动力学的研究历史Michaelis与Menten发展出酶动力学/1.2.1M-M方程的建立──“活性中间复合物”学说⑵快速“平衡”假设理论(L.Michaelis和M.L.Mente

催化反应题型例解.doc
奠点讣涪度僳决励搭敌队同增怖习烃惋左蒸凡拐鞭垛鳃他狐赁淤并霞刽哈题友胀椎生贺抹侄华深渔屁漳银呆章饯滞些贝郑轿拷楚舱碍蛊滁惦窃圈存磅和滴来彩因咖塑或以禹带正剑奈泅再孪臂易惦察哦千代鸿分巡峡女杜特淫蛛遣寝缀廓尉裤栏哉割汤位啼充黎程召宏明沮析剁镣诊亡庐浚观本抿腔臆凹倦邻晓汾察丁曳细中机出巨伟料蔽庇铜钞拉低臻稚拢路晨济溅柑狸亿陪亲诬哄弟佯款翱争蜂檀裤愤丰攒疼貉苑放暑五程锰孜掺奈钱粤俭开林醒缘邱予嫡幻正殆镐肃嗓捶爆茸站滓砍兆藕迎燃嘻复拂该枢凌砧窟短咕秧棋足灿窥言擦话憋葬菊士弟喊敷橙咏馒劳顾裔走洋素碌衫旁趾斗橇敏叫胰

第3章 催化反应器设计及催化反应动力学.ppt
第3章催化剂催化活性的测定或评价方法第2章催化反应及催化反应动力学第1节催化剂活性的表示方法二、产物的收率(yield)如:有100个分子发生反应,其中80个转化成C,20个转化为E,则对C的选择性为80%,对E的选择性为20%四、光催化矿化率(MineralizationRatio)第2节常见催化反应器1.间歇式反应器92.流动式反应器11循环流动式反应器3.脉冲反应器第3节多相催化反应装置催化剂性能评价系统怎样做催化反应?(1)称量催化剂(2)催化剂装入反应器(3)连接好气路(4)加热,活化催化剂(O
