
铁铜及其重要化合物高三一轮复习上课.ppt

YY****。。









亲,该文档总共80页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

铁铜及其重要化合物高三一轮复习上课.pptx
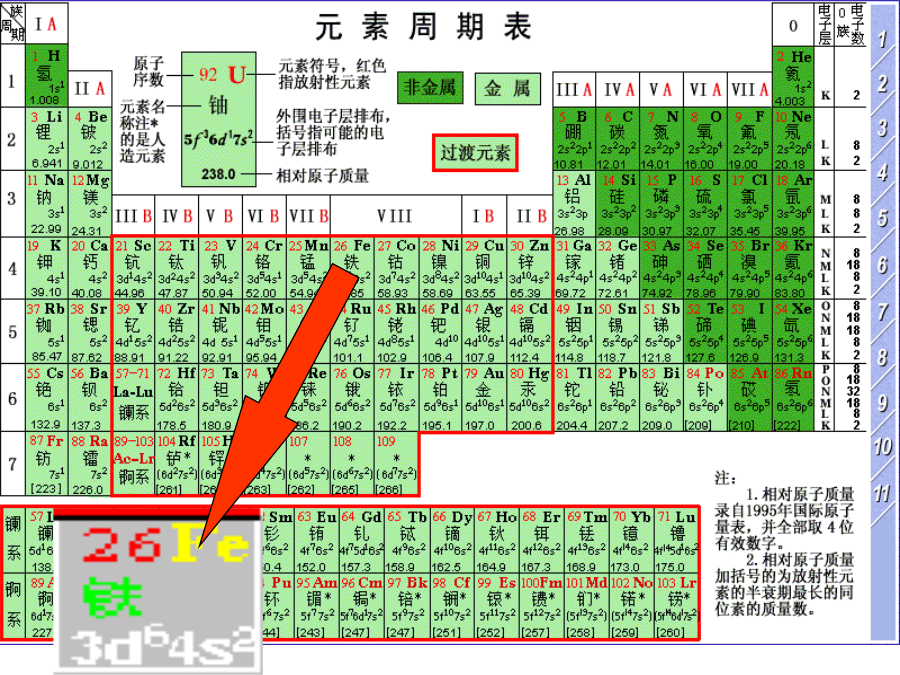
会计学铁、铜在自然界中的存在:34铁、铜的物理性质:思考:1.铁在地壳中的含量?2.Fe、Fe2+、Fe3+的结构特点?3.铁在周期表中的位置?位置二、铁的化学性质:1、铁与强氧化剂反应:2、铁与弱氧化剂反应:4、与水的反应:/143、将铁粉撒入下列溶液中充分反应后,溶液的质量增加但无气体放出的是()A、CuCl2B、HClC、浓HNO3D、FeCl3解:设生成的Cu的质量为x18请同学们写出铁的三种氧化物与稀硝酸反应的化学方程式21Fe(OH)3+3H+=Fe3++3H2O2Fe(OH)3=Fe2O3+

铁铜及其重要化合物高三一轮复习上课.ppt
第三章金属元素及其化合物考纲要求1、掌握Fe在周期表中的位置、结构特点、主要化学性质2、掌握铁的氧化物、氢氧化物的主要性质3、掌握Fe、Fe2+、Fe3+的相互转化,并能正确写出有关的氧化还原反应的离子方程式4、掌握Fe2+、Fe3+的检验方法5、了解炼铁和炼钢的原理6、了解铜及其重要化合物的性质铁、铜在自然界中的存在:常见的铁矿石常见的铜矿石铁、铜的物理性质:思考:1.铁在地壳中的含量?2.Fe、Fe2+、Fe3+的结构特点?3.铁在周期表中的位置?位置二、铁的化学性质:1、铁与强氧化剂反应:2、铁与弱

铁铜及其重要化合物高三一轮复习上课.ppt
12铁、铜在自然界中的存在:45铁、铜的物理性质:思考:1.铁在地壳中的含量?2.Fe、Fe2+、Fe3+的结构特点?3.铁在周期表中的位置?位置二、铁的化学性质:1、铁与强氧化剂反应:2、铁与弱氧化剂反应:4、与水的反应:153、将铁粉撒入下列溶液中充分反应后,溶液的质量增加但无气体放出的是()A、CuCl2B、HClC、浓HNO3D、FeCl3解:设生成的Cu的质量为x19请同学们写出铁的三种氧化物与稀硝酸反应的化学方程式22Fe(OH)3+3H+=Fe3++3H2O2Fe(OH)3=Fe2O3+3H

高三化学一轮复习——铁铜及其重要化合物.ppt
铁、铜及其化合物2、常温下可盛放浓硫酸的容器是()A.NaB.FeC.ZnD.Mg5、下列4种铁的化合物溶于稀盐酸后,滴加KSCN溶液没有颜色变化,再加氯水呈红色的是()A.Fe(OH)3B.Fe2O3C.FeCl3D.FeSO47久置于空气中的下列物质,因被氧化而呈黄色的是()A.浓HNO3B.氯化亚铁溶液C.溴苯D.溴化银10.把铁、铜、FeCl3、FeCl2和CuCl2溶液混在一起,铁有剩余,则溶液中所含最多的阳离子是()A.H+B.Cu2+C.Fe3+D.Fe2+BC【考纲解读】铁Fe反应后形成的

高三化学一轮复习——铁铜及其重要化合物.pptx
会计学2、常温下可盛放浓硫酸的容器是()A.NaB.FeC.ZnD.Mg5、下列4种铁的化合物溶于稀盐酸后,滴加KSCN溶液没有颜色变化,再加氯水呈红色的是()A.Fe(OH)3B.Fe2O3C.FeCl3D.FeSO47久置于空气中的下列物质,因被氧化而呈黄色的是()A.浓HNO3B.氯化亚铁溶液C.溴苯D.溴化银10.把铁、铜、FeCl3、FeCl2和CuCl2溶液混在一起,铁有剩余,则溶液中所含最多的阳离子是()A.H+B.Cu2+C.Fe3+D.Fe2+BC【考纲解读】铁Fe反应后形成的产物呈何价
