
晶体结构与性质知识要点归纳2.ppt

赫赫****等你









亲,该文档总共27页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

晶体结构与性质知识要点归纳2.ppt
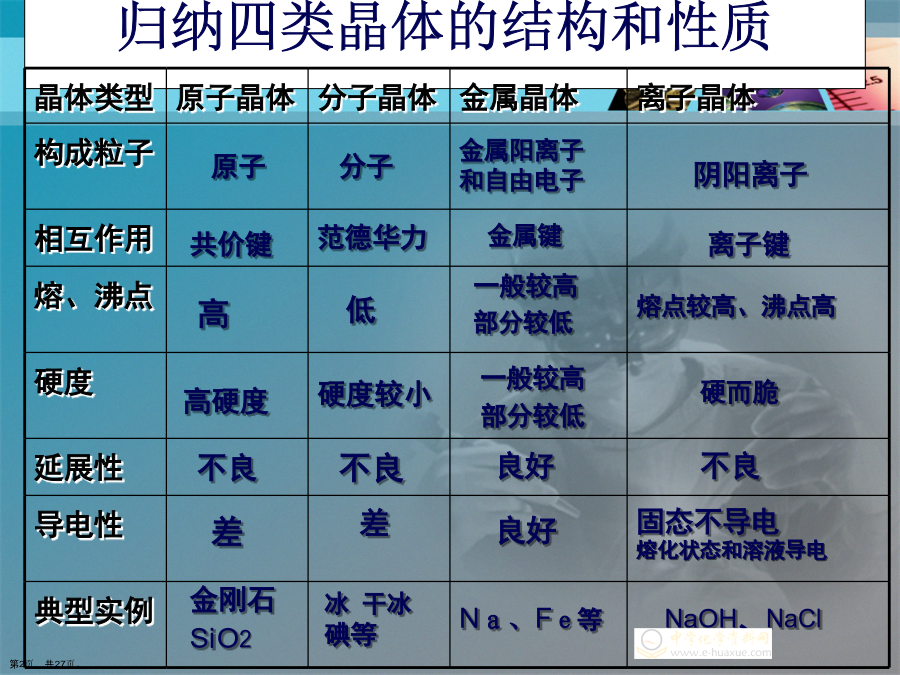
晶体结构与性质知识要点归纳归纳四类晶体的结构和性质1、定义:2、最小微粒:3、微粒之间的作用关系:——分子间作用力或分子间作用力和氢键二、分子晶体判定方法:三、决定分子晶体熔沸点高低及硬度大小的因素1、定义:原子间以共价键相结合而形成的空间网状结构的晶体。2、最小微粒:原子3、微粒之间的作用关系:——共价键7、原子晶体判定方法:1、定义:金属阳离子和自由电子之间的较强作用2、最小微粒:金属阳离子和自由电子3、微粒之间的作用关系:——金属键7、金属晶体判定方法:1、定义:2、最小微粒:3、微粒之间的作用关系

晶体结构与性质知识要点归纳.ppt
晶体结构与性质知识要点归纳归纳四类晶体的结构和性质分子晶体知识要点小结1、定义:2、最小微粒:3、微粒之间的作用关系:——分子间作用力或分子间作用力和氢键二、分子晶体判定方法:三、决定分子晶体熔沸点高低及硬度大小的因素原子晶体知识要点小结1、定义:原子间以共价键相结合而形成的空间网状结构的晶体。2、最小微粒:原子3、微粒之间的作用关系:——共价键7、原子晶体判定方法:金属晶体知识要点小结1、定义:金属阳离子和自由电子之间的较强作用2、最小微粒:金属阳离子和自由电子3、微粒之间的作用关系:——金属键7、金属

晶体结构与性质知识要点归纳-PPT.ppt
晶体结构与性质知识要点归纳归纳四类晶体的结构和性质1、定义:2、最小微粒:3、微粒之间的作用关系:——分子间作用力或分子间作用力和氢键二、分子晶体判定方法:三、决定分子晶体熔沸点高低及硬度大小的因素1、定义:原子间以共价键相结合而形成的空间网状结构的晶体。2、最小微粒:原子3、微粒之间的作用关系:——共价键7、原子晶体判定方法:1、定义:金属阳离子和自由电子之间的较强作用2、最小微粒:金属阳离子和自由电子3、微粒之间的作用关系:——金属键7、金属晶体判定方法:1、定义:2、最小微粒:3、微粒之间的作用关系

晶体结构与性质-归纳与整理.ppt
(1)晶体自范性的本质:是晶体中粒子微观空间里呈现周期性的有序排列的宏观表象.(2)晶体自范性的条件之一:生长速率适当.2.晶体形成的途径二.晶胞立方晶胞石墨晶体的层状结构,层内为平面正六边形结构(如图),试回答下列问题:(1)图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个。碳原子数目与碳碳化学键数目之比为_______.三.四种晶体的比较晶体熔沸点高低的判断四、金属晶体的原子堆积模型三维堆积-四种方式三、金属晶体的四种堆积模型对比四.离子晶体NaCl晶体在氯化铯晶体中,每个Cl

晶体结构与性质归纳与整理.pptx
会计学3.5《晶体结构与性质-归纳与整理》(1)晶体自范性的本质:是晶体中粒子微观空间里呈现周期性的有序排列的宏观表象.(2)晶体自范性的条件之一:生长速率适当.2.晶体形成的途径二.晶胞立方晶胞石墨晶体的层状结构,层内为平面正六边形结构(如图),试回答下列问题:(1)图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个。碳原子数目与碳碳化学键数目之比为_______.三.四种晶体的比较晶体熔沸点高低的判断四、金属晶体的原子堆积模型三维堆积-四种方式三、金属晶体的四种堆积模型对比四.离
