
复分解反应实质.ppt

朋兴****en






在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

复分解反应实质.ppt
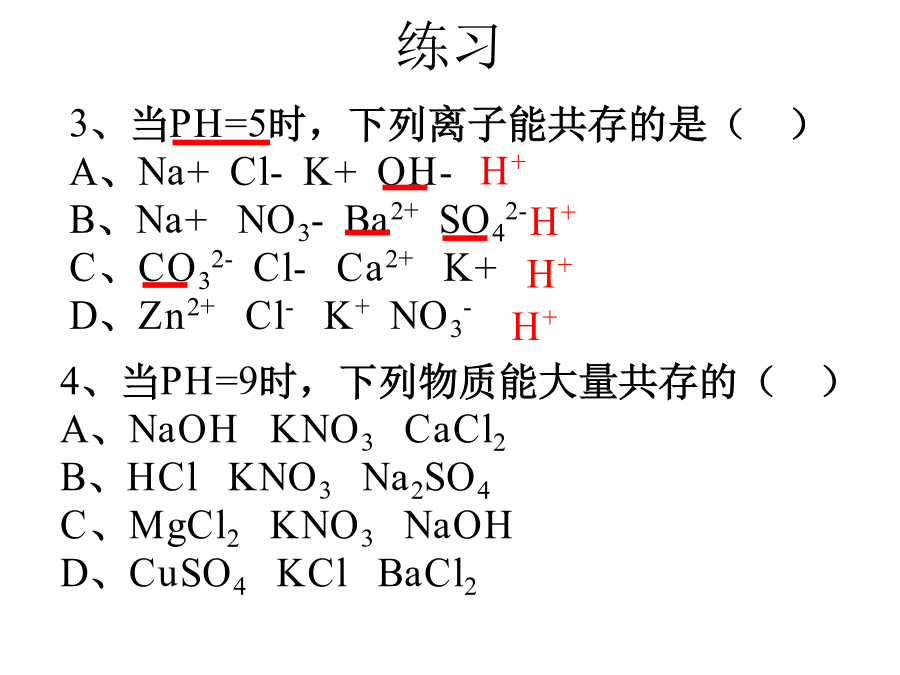
复分解反应的实质与离子共存1.H+和OH-反应生成H2O。2.H+和CO32-、HCO3-反应生成H2O和CO2气体。3.NH4+和OH-会生成NH3和H2O。4.Ca2+与CO32-反应生成CaCO3沉淀。Cu2+、Fe3+都与OH-会生成Cu(OH)2、Fe(OH)3沉淀,Ag+与Cl-生成AgCl沉淀,Ba2+与SO42-、CO32-生成BaSO4和BaCO3沉淀。1.初中化学常见的7个沉淀:AgCl、BaSO4、BaCO3CaCO3、Mg(OH)2、Cu(OH)2、Fe(OH)3总结:看到Ba2+

复分解反应的实质.ppt
复分解反应的实质与离子共存1.H+和OH-反应生成H2O。2.H+和CO32-、HCO3-反应生成H2O和CO2气体。3.NH4+和OH-会生成NH3和H2O。4.Ca2+与CO32-反应生成CaCO3沉淀。Cu2+、Fe3+都与OH-会生成Cu(OH)2、Fe(OH)3沉淀,Ag+与Cl-生成AgCl沉淀,Ba2+与SO42-、CO32-生成BaSO4和BaCO3沉淀。1.初中化学常见的7个沉淀:AgCl、BaSO4、BaCO3CaCO3、Mg(OH)2、Cu(OH)2、Fe(OH)3总结:看到Ba2+

复分解反应的实质.ppt
复分解反应的实质与离子共存1.H+和OH-反应生成H2O。2.H+和CO32-、HCO3-反应生成H2O和CO2气体。3.NH4+和OH-会生成NH3和H2O。4.Ca2+与CO32-反应生成CaCO3沉淀。Cu2+、Fe3+都与OH-会生成Cu(OH)2、Fe(OH)3沉淀,Ag+与Cl-生成AgCl沉淀,Ba2+与SO42-、CO32-生成BaSO4和BaCO3沉淀。1.初中化学常见的7个沉淀:AgCl、BaSO4、BaCO3CaCO3、Mg(OH)2、Cu(OH)2、Fe(OH)3总结:看到Ba2+

复分解反应实质的探究.doc
反思、归纳与提升是化学学习的重要方法。对于复分解反应及其规律,通过反思与探索,同学们有了新的认识。请填写下文中横线上的空白。【知识回顾】1.氯化氢气体、氢氧化钠固体不导电。2.盐酸、氢氧化钠溶液能导电【分析归纳】氯化氢溶于水:HCl→Na++Cl-氢氧化钠溶于水:NaOH→Na++OH-结论:溶液导电是由于溶液中存在自由移动的离子。【迁移运用】硫酸钠溶液能导电,原因是硫酸钠溶于水:Na2SO4→________。【探索发现】(1)氢氧化钠溶液与盐酸反应的微观示意图【分析归纳】反应的化学方程式:______

复分解反应的实质(WORD.doc
复分解反应的实质在溶液中发生的复分解反应大多是在酸、碱、盐之间进行的,而酸、碱、盐都是电解质,在溶液中都能电离出离子。因此,复分解反应的实质,实际上是电解质在溶液中发生的离子间的互换反应。当溶液中存在的某些离子能互相结合而使其浓度迅速减小的话,那么反应就向减小离子浓度的方向进行。如果用离子方程式表示发生的复分解反应,就更能反映出它的实质,例如酸和碱发生的中和反应,其实质就是H+和OH-结合生成了难电离的水,而使溶液中H+和OH-的离子浓度迅速减小,反应便瞬时完成了:H++OH
