
络合物催化剂和其催化作用课件.ppt

ca****ng









亲,该文档总共62页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

络合物催化剂和其催化作用课件.ppt
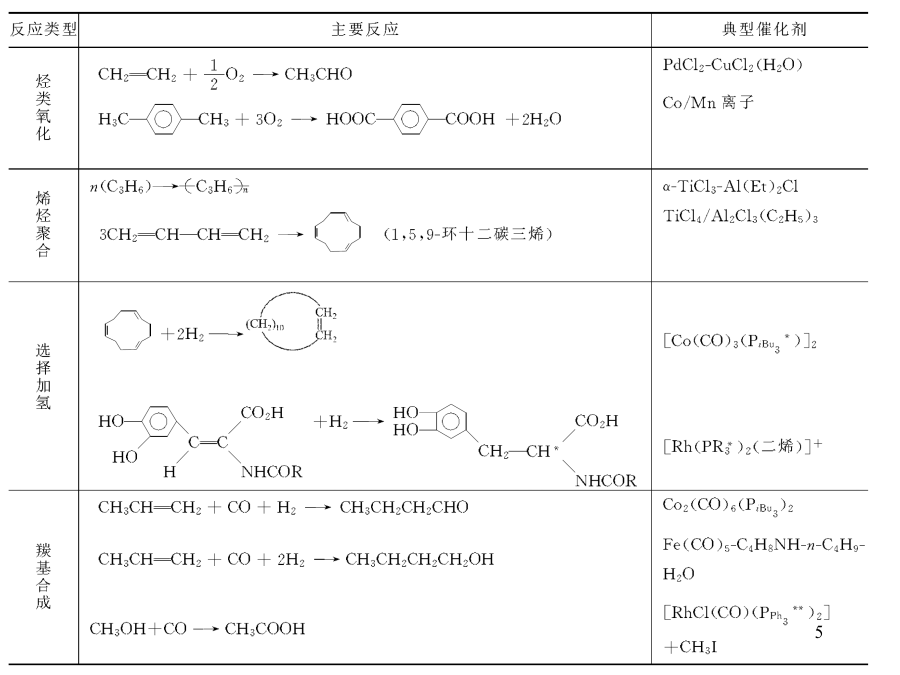
络合物催化剂和其催化作用PPT讲座第六章络合物的催化及其催化作用主要内容6.1.1络合物催化剂的应用(Applicationofcomplexescatalysts)5A.价键理论中心离子或原子为d0或d10,有九个轨道nd(n+1)s(n+1)p是空的,而且这些轨道在能量上非常接近,有接受电子的能力,可以为配位体提供空轨道而形成配位键。如:d0(Sc3+,Ti4+),d10(Cu+,Ag+,Zn2+)coord.OhO球形场a、络合物中键形成中心离子(或原子)过渡金属,如第四周期元素外层原子轨道包括3

络合物催化剂及其催化作用.pptx
会计学234567891011121314151617181920212223242526272829303132333435363738394041424344454647484950515253545556575859606162

4催化剂和催化作用微课件(1).ppt
一、概念二、特点三、催化剂的作用及种类巩固练习再见

催化剂和催化作用.doc
催化剂和催化作用:2019年中考化学复习备考查字典物理网为大家整理出初三化学各个单元的知识点希望对大家有所帮助。催化剂和催化作用催化剂是指在化学反应中能改变其他物质的反应速率而本身的质量和化学性质在化学反应前后都没有改变的物质。催化剂在化学反应中所起的作用叫催化作用。注意:①催化剂改变其他物质的反应速率这里的改变包括加快或减慢的含义②催化剂的化学性质在化学反应前后没有改变但物理性质可能改变③催化剂是针对具体的反应而言的如二氧化锰在过氧化氢分解制取氧气时能够起催化作用是催化剂;但二氧化锰

镍和钯络合物的合成及其对交叉偶联反应催化作用.docx
镍和钯络合物的合成及其对交叉偶联反应催化作用标题:镍和钯络合物的合成及其对交叉偶联反应催化作用摘要:镍和钯络合物是非常重要的催化剂,广泛应用于有机合成中的交叉偶联反应。本论文将系统地讨论镍和钯络合物的合成方法,以及它们在不同类型交叉偶联反应中的催化作用机理和性能。通过理解这些催化剂的特点,我们可以更好地设计和优化催化剂系统,以实现高效、高选择性和环境友好的有机合成。1.引言交叉偶联反应是有机合成中重要的反应类型之一,通过在不同的官能团之间建立化学键,可以构建复杂分子结构。镍和钯络合物是在许多交叉偶联反应中
