
物质成分和含量的测定学-PPT课件.ppt

lj****88




亲,该文档总共17页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

物质成分和含量的测定学-PPT课件.ppt
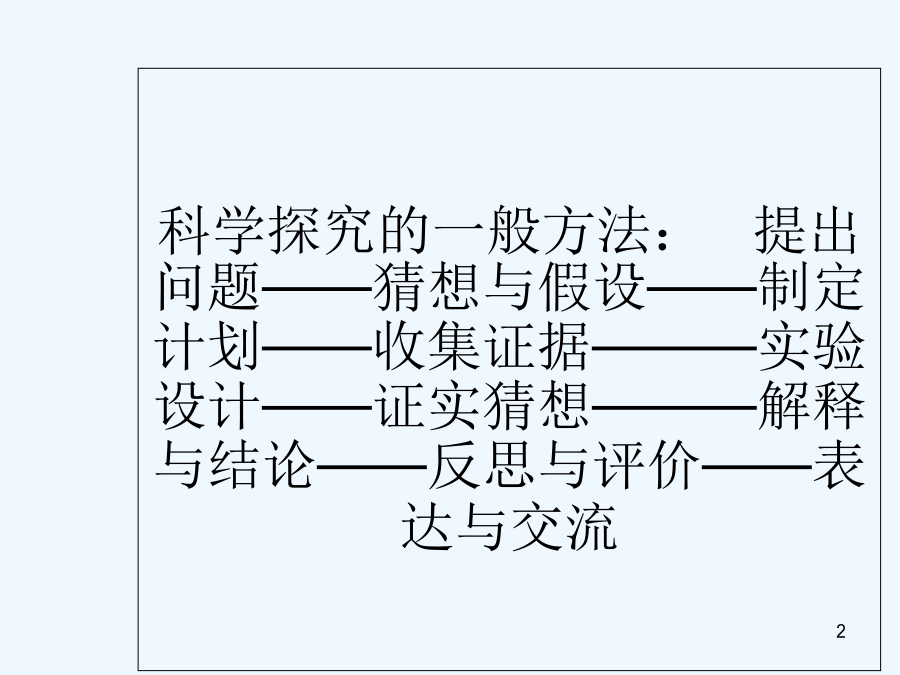
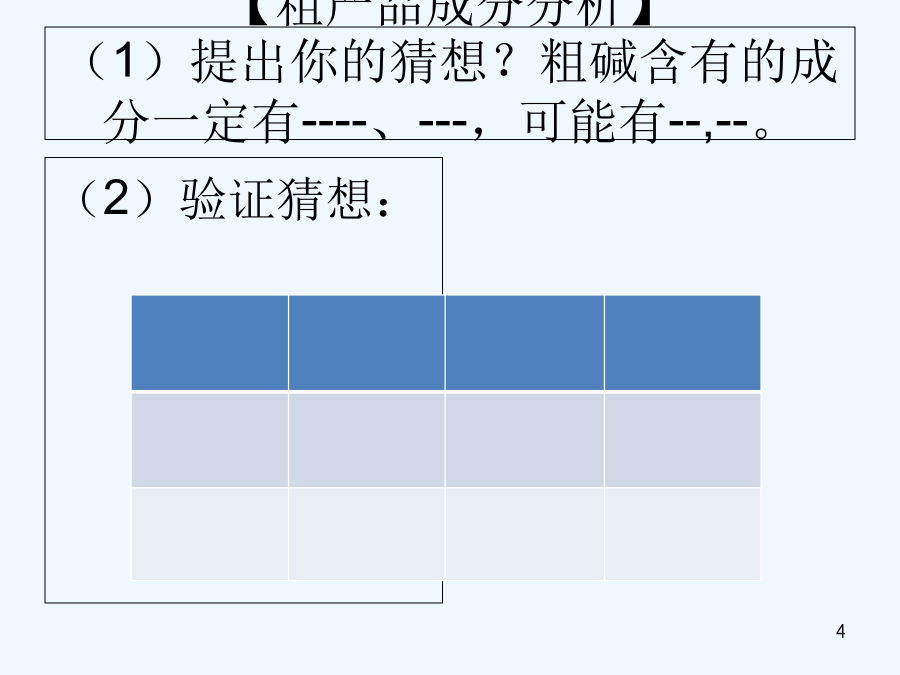
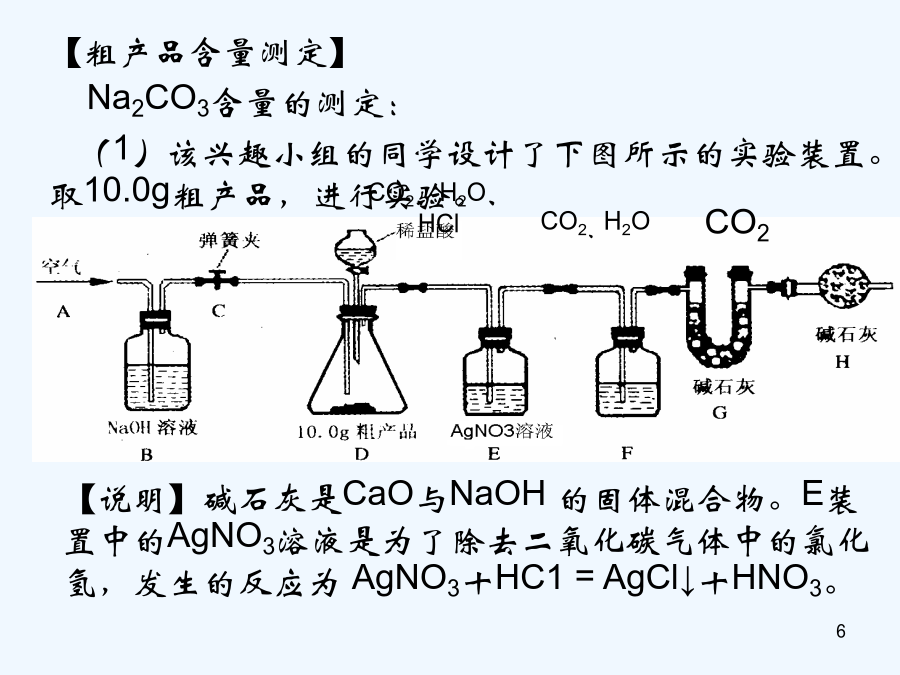
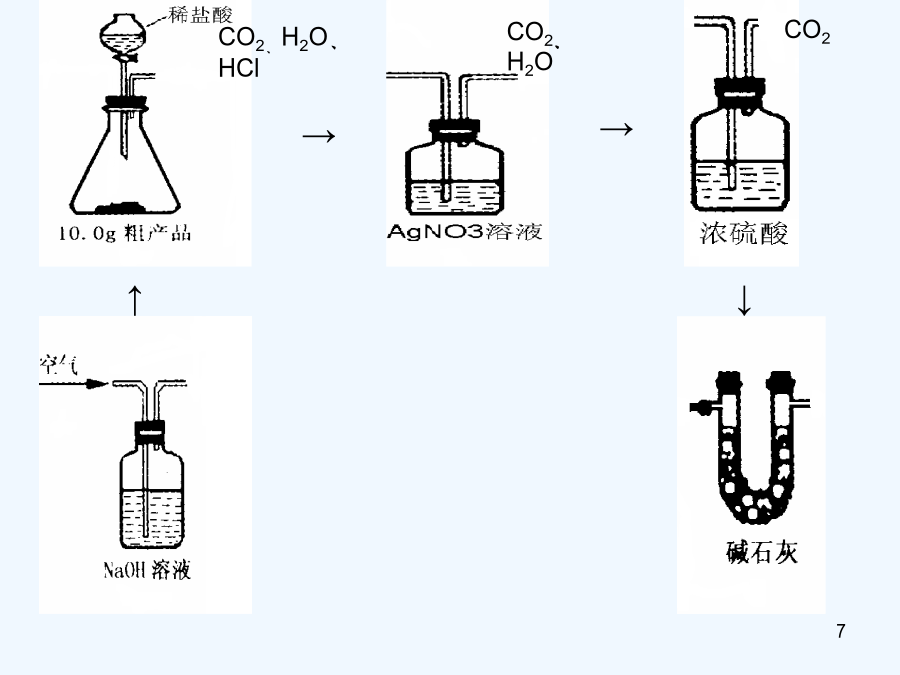
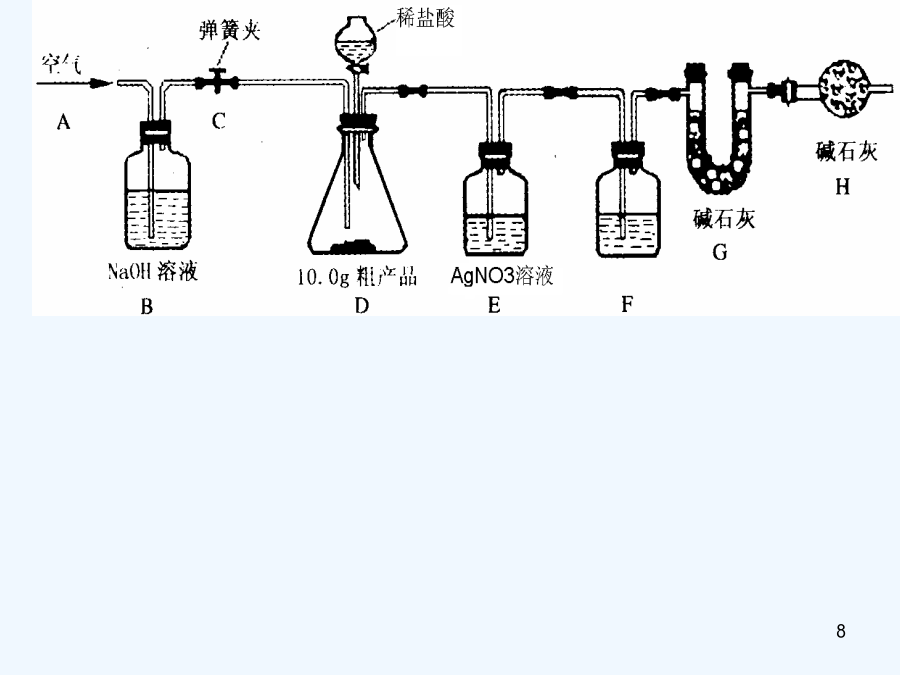
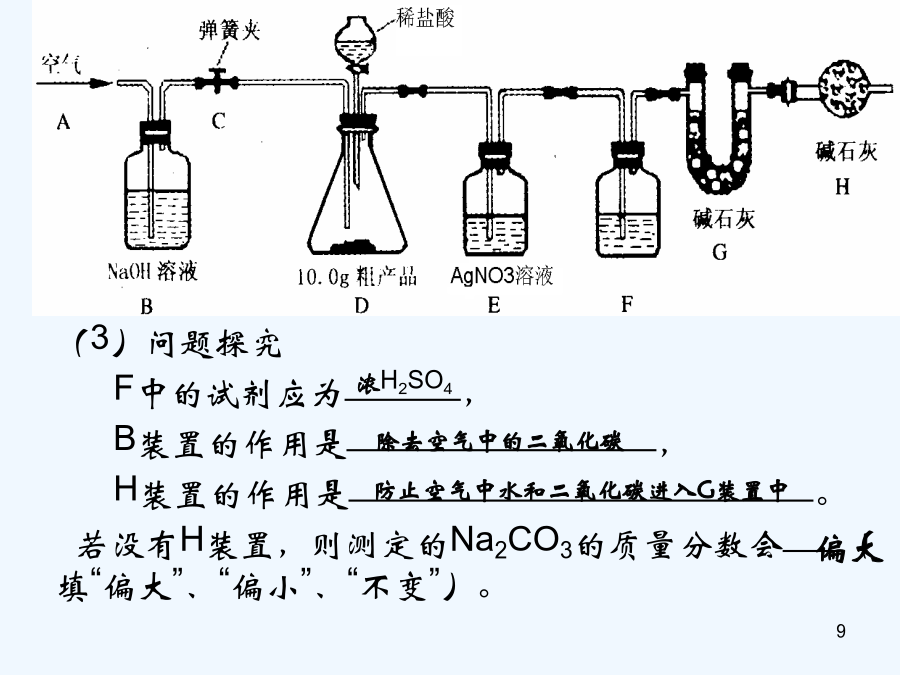
物质成分和含量的测定科学探究的一般方法:提出问题——猜想与假设——制定计划——收集证据———实验设计——证实猜想———解释与结论——反思与评价——表达与交流课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na2CO3,还含有少量NaCl,其它杂质不计)和石灰乳为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定。【粗产品制备】(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程为。(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品。【粗产品成分分

物质成分含量的测定课件教案.pptx
会计学长期置于空气中的NaOH固体试样,它可能变成什么呢?物质成分和含量的测定学习重点1、对物质中可能含有的成分进行合理的猜想2、能根据猜想设计合理的实验方案进行成分验证和含量测定3、对实验方案进行科学的评价学习难点1、成分的猜想2、方案的设计及评价3、数据处理课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na2CO3,还含有少量NaCl,其它杂质不计)和石灰乳为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定。【粗产品制备】(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发

物质含量的测定-PPT课件.ppt
新课标人教版课件系列3.2《物质含量的测定》课题二物质含量的测定酸碱中和滴定法什么是酸碱中和滴定?一、酸碱中和滴定的原理1、原理:酸碱中和滴定是以酸碱中和反应为基础的,反应的实质是:H++OH-=H2O即酸提供的氢离子总数(nH+)等于碱提供的氢氧根总数(nOH-)。用已知物质的量浓度的一元酸(标准溶液)滴定未知物质的量浓度一元碱(待测溶液),则:酸碱中和滴定的关键酸碱指示剂是有机色素,是有机弱酸(HIn)或有机弱碱(InOH),在水里也存在电离平衡:常用酸碱指示剂有石蕊、酚酞、甲基橙,但用于酸碱中和滴定

物质成分含量的测定.pptx
九年级化学专题复习长久置于空气中旳NaOH固体试样,它可能变成什么呢?物质成份和含量旳测定学习要点1、对物质中可能具有旳成份进行合理旳猜测2、能根据猜测设计合理旳试验方案进行成份验证和含量测定3、对试验方案进行科学旳评价学习难点1、成份旳猜测2、方案旳设计及评价3、数据处理课外化学爱好小组旳同学利用某化工厂旳废碱液(主要成份为Na2CO3,还具有少许NaCl,其他杂质不计)和石灰乳为原料制备烧碱,并对所得旳烧碱粗产品旳成份进行分析和测定。【粗产品制备】(1)将废碱液加热蒸发浓缩,形成较浓旳溶液,冷却后与石

物质成分含量的测定.pptx
会计学长期置于空气中的NaOH固体试样,它可能变成什么呢?物质成分和含量的测定学习重点1、对物质中可能含有的成分进行合理的猜想2、能根据猜想设计合理的实验方案进行成分验证和含量测定3、对实验方案进行科学的评价学习难点1、成分的猜想2、方案的设计及评价3、数据处理课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na2CO3,还含有少量NaCl,其它杂质不计)和石灰乳为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定。【粗产品制备】(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发
