
无机化学卤素ppt课件.ppt

天马****23








亲,该文档总共50页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

无机化学卤素ppt课件.ppt
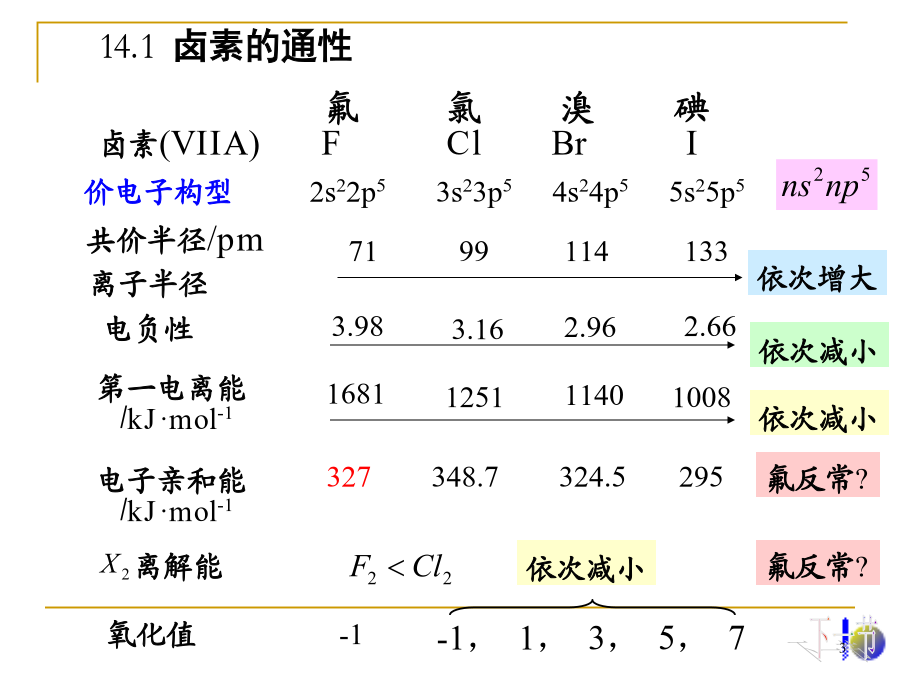
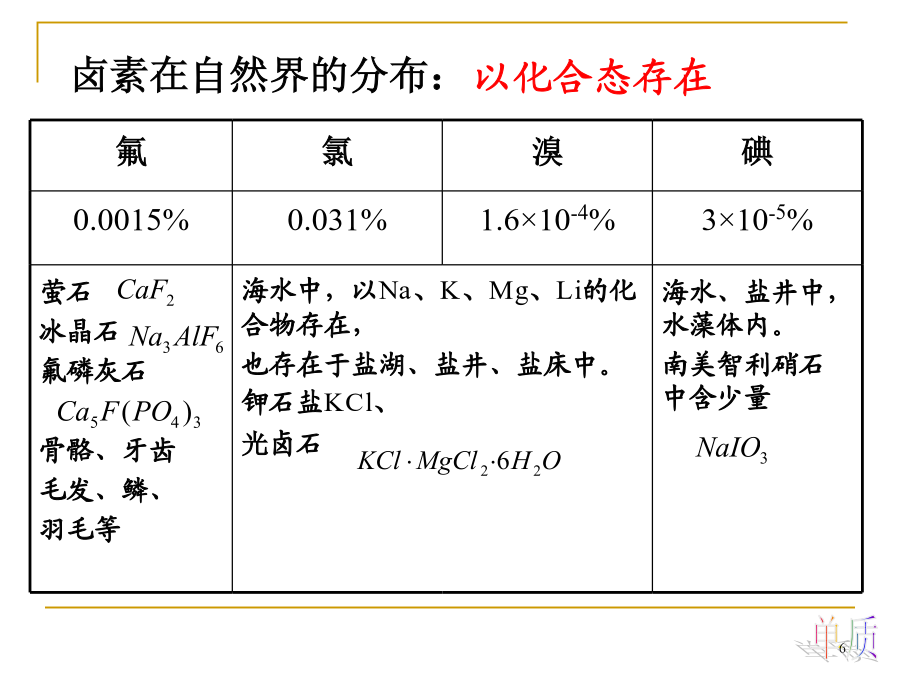
14卤素本章重点:卤素(VIIA)FClBrI§14.2卤素的单质及其化合物14.2.1卤素的成键特征卤素在自然界的分布:1.卤素单质的物理性质:F2Cl2Br2I2①与金属作用:③与氢作用:激烈程度歧化反应产物:(氧化手段的选择)Br2(l)I2(s)常温下,卤化氢都是无色具有刺激性气味的气体。①HX为共价化合物,属极性分子,溶沸点较低;②易液化,液态不导电;③具刺激性气味、无色气体,潮气中冒烟;④易溶于水形成氢卤酸,除氢氟酸为弱酸外,均为强酸。3)腐蚀性HBr和HIHCl卤化物水解3.卤化氢的性质递变

化学竞赛无机化学绝密-卤素ppt课件.ppt
第十六章卤素氯Cl主要以氯化钠的形式存在于海水、盐湖、盐井中。溴Br主要存在于海水中,盐湖和盐井中也存在少量的溴。碘I碘在海水中存在的更少,主要被海藻所吸收。碘也存在于某些盐井、盐湖中。南美洲智利硝石含有少许的碘酸钠。砹At砹属于放射性元素,不列为本章研究内容。16.1卤素单质F2Cl2Br2I22.颜色浅黄黄绿红棕紫为什么Cl2吸收能量高的紫光,Br2吸收能量居中的蓝绿光,而I2却吸收能量较低的黄绿光?卤素单质的双原子分子轨道图卤素吸收部分可见光,以满足电子从最高占有轨道*,向最低空轨道*跃迁所需的

简明无机化学卤素课件.ppt
第八章卤素氯Cl主要以氯化钠的形式存在于海水、盐湖、盐井中。溴Br主要存在于海水中,盐湖和盐井中也存在少量的溴。碘I碘在海水中存在的更少,主要被海藻所吸收。碘也存在于某些盐井、盐湖中。南美洲智利硝石含有少许的碘酸钠。砹At砹属于放射性元素,不列为本章研究内容。8.1卤素单质F2Cl2Br2I22.颜色浅黄黄绿红棕紫为什么Cl2吸收能量高的紫光,Br2吸收能量居中的蓝绿光,而I2却吸收能量较低的黄绿光?卤素单质的双原子分子轨道图卤素吸收部分可见光,以满足电子从最高占有轨道*,向最低空轨道*跃迁所需的能量

化学竞赛无机化学绝密课件卤素.ppt
第十六章卤素氯Cl主要以氯化钠的形式存在于海水、盐湖、盐井中。溴Br主要存在于海水中,盐湖和盐井中也存在少量的溴。碘I碘在海水中存在的更少,主要被海藻所吸收。碘也存在于某些盐井、盐湖中。南美洲智利硝石含有少许的碘酸钠。砹At砹属于放射性元素,不列为本章研究内容。16.1卤素单质F2Cl2Br2I22.颜色浅黄黄绿红棕紫为什么Cl2吸收能量高的紫光,Br2吸收能量居中的蓝绿光,而I2却吸收能量较低的黄绿光?卤素单质的双原子分子轨道图卤素吸收部分可见光,以满足电子从最高占有轨道*,向最低空轨道*跃迁所需的

化学竞赛无机化学绝密课件-卤素.ppt
第十六章卤素氯Cl主要以氯化钠的形式存在于海水、盐湖、盐井中。溴Br主要存在于海水中,盐湖和盐井中也存在少量的溴。碘I碘在海水中存在的更少,主要被海藻所吸收。碘也存在于某些盐井、盐湖中。南美洲智利硝石含有少许的碘酸钠。砹At砹属于放射性元素,不列为本章研究内容。16.1卤素单质F2Cl2Br2I22.颜色浅黄黄绿红棕紫为什么Cl2吸收能量高的紫光,Br2吸收能量居中的蓝绿光,而I2却吸收能量较低的黄绿光?卤素单质的双原子分子轨道图卤素吸收部分可见光,以满足电子从最高占有轨道*,向最低空轨道*跃迁所需的
