
滴定概论.ppt

lj****88








亲,该文档总共58页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

滴定概论.ppt
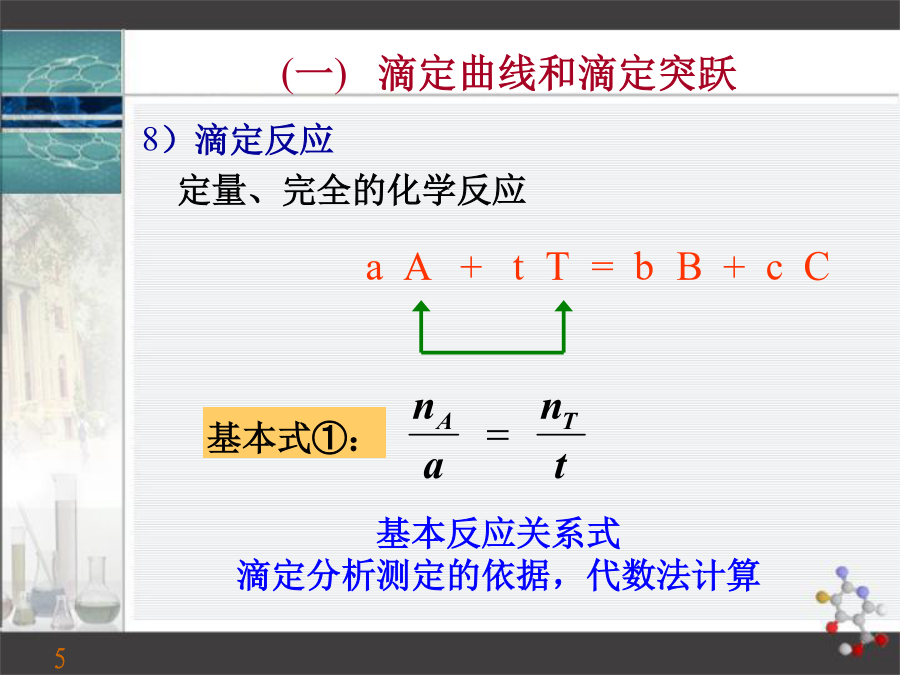
第三章滴定分析概论第一节滴定分析法和滴定方式一、滴定分析法(一)滴定曲线和滴定突跃8)滴定反应定量、完全的化学反应滴定突跃滴定过程中计量点前后测量参数的突变。是衡量滴定是否可行的依据,又是选择指示剂的依据。滴定突跃范围突跃所在测量参数的范围,即计量点前后±0.1%相对误差范围内溶液测量参数值的变化。[In-]≥10[XIn],只能看到In‾色[XIn]≥10[In-],只能看到XIn色[In-]=[XIn],指示剂的理论变色点0.1≤[In-]/[XIn]≤10,理论变色范围指示剂的选择原则:使指示剂的变

滴定分析概论.docx
1.2滴定分析概述一.过程和特点滴定分析法是化学分析中的重要方法之一。使用滴定管将一种已知准确浓度的试剂溶液即标准溶液,滴加到待测物的溶液中,直到待测组分恰好完全反应,即加入标准溶液的物质的量与待测组分的物质的量符合反应式的化学计量关系,然后根据标准溶液的浓度和所消耗的体积,算出待测组分的含量,这一类分析方法通称为滴定分析法(或称容量分析法)。滴加标准溶液的操作过程称为滴定。滴加的标准溶液与待测组分恰好反应完全的这一点,称为化学计量点,在化学计量点时,反应往往没有易为人察觉的任何外部特征,因此一般是在待测

《滴定分析概论》.ppt
滴定分析概论Titrimetricanalysis重点、要点滴定分析的基本术语用途和特点滴定分析对滴定反应的要求几种滴定分析法络合滴定法:是以络合反应为基础的一种滴定分析法。如EDTA滴定法:M+Y=MY氧化还原滴定法:是以氧化还原反应为基础的一种滴定分析法。如KMnO4法MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O滴定方式先准确加入过量标准溶液,使与试液中的待测物质或固体试样进行反应,待反应完成以后,再用另一种标准溶液滴定剩余的标准溶液的方法。适用于反应较慢或难溶于水的固体试样。如ED

《绪论,滴定概论》.ppt
滴定分析法概述标准溶液与基准物质滴定度计算示例滴定分析法:一、滴定分析的基本术语:滴定管常用滴定分析仪器二、滴定分析法的分类2.按滴定方式分类三、滴定分析法对滴定反应的要求直接滴定返滴定法(剩余滴定法)例1:Al3++定过量EDTA标液剩余EDTAZn2+标液,EBT返滴定例2:固体CaCO3+定过量HCl标液剩余HCl标液NaOH标液返滴定例3:Cl-+定过量AgNO3标液剩余AgNO3标液NH4SCN标液Fe3+指示剂返滴定淡红色[Fe(SCN)]2+置换滴定法例4:Na2S2O3+K2Cr2O7S4

滴定分析概论习题.doc
思考题与习题解释以下名词术语:滴定分析法,滴定,标准溶液(滴定剂),标定,化学计量点,滴定终点,滴定误差,指示剂,基准物质。答:滴定分析法:将一种已知准确浓度的试剂溶液(即标准溶液)由滴定管滴加到被测物质的溶液中,直到两者按照一定的化学方程式所表示的计量关系完全反应为止,然后根据滴定反应的化学计量关系,标定溶液的浓度和体积用量,计算出被测组分的含量,这种定量分析的方法称为滴定分析法。滴定:在用滴定分析法进行定量分析时,先将被测定物质的溶液置于一定的容器中(通常为锥形瓶),在适宜的条件,再另一种标准溶液通过
