
气相色谱分析PPT课件.ppt

lj****88









亲,该文档总共101页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

气相色谱分析PPT课件.ppt
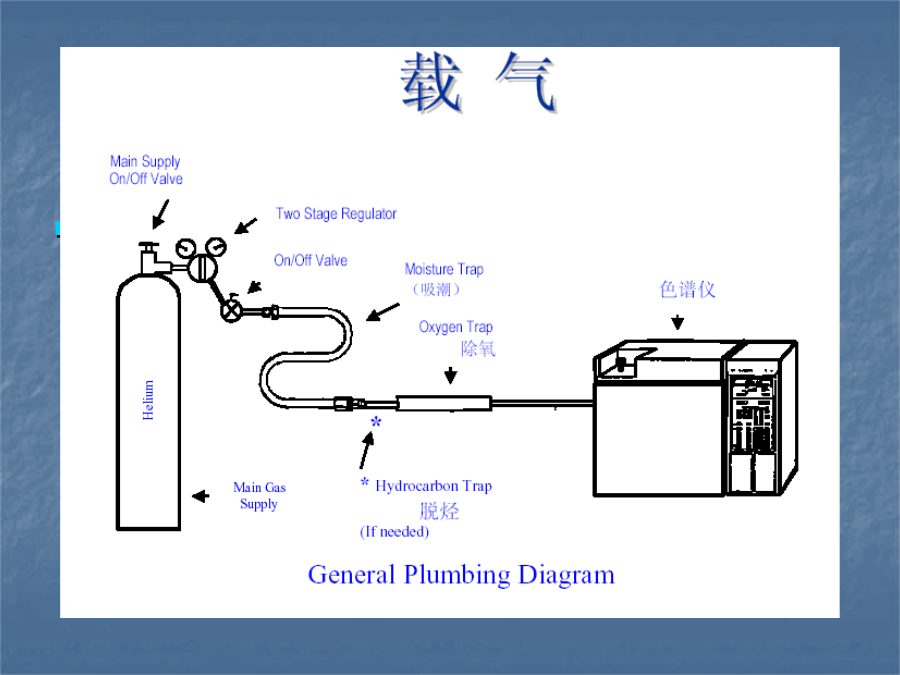
气相色谱分析国产气相色谱仪图1、色谱过程图2、色谱图色谱图界面色谱过程的基本方程式:有效塔板数(neff)的计算公式为;另毛细管柱高效液相色谱法:特指一种用液体为流动相的色谱分离分析方法。它在经典色谱理论的基础上,采用了高压泵、化学键合固定相高效分离柱、高灵敏专用检测器等新实验技术建立的一种液相色谱分析法。高压:150-350*105Pa高效:大于30000塔板/米高灵敏:10-9g(紫外检测)、10-11g(荧光检测)一、HPLC与GC差别2.流动相差别的区别GC:流动相为惰性,气体组分与流动相无亲合作

气相色谱分析ppt课件.ppt
第二章气相色谱分析一、裂解气相色谱的原理与应用applicationandtechnologyofpyrolysisgaschromatograph1.基本原理及方法特点:2.流程3.对裂解器的要求4.裂解器二、顶空气相色谱的技术与应用applicationsandtechnologyofheadspacegaschromatograph理论依据应用1:应用2:应用3:内容选择此课件下载可自行编辑修改,此课件供参考!部分内容来源于网络,如有侵权请与我联系删除!感谢你的观看!

气相色谱分析原理与技术ppt课件.ppt
气相色谱分析原理与技术气相色谱分析原理.技术.应用色谱法(chromatography)亦称色层法、层析法,是一种分离技术,当其应用于分析化学领域,并与适当的检测手段相干结合,就构成色谱分析法一、各种色谱分类方法2、按固定相的性质分类3、按分离原理分类4.按动力学分类(2)顶替法(也叫排代法),将试样加到色谱柱的头上然后用一种对固定相的吸附或溶解能力比所有试样组份都强的顶替剂将个组份依次顶替出色谱柱,吸附或溶解能力弱的组份首先流出色谱柱,强的最后流出.用于族分析,如油品中的烷,烯,芳烃的分离.三种色谱动力

气相色谱分析仪器PPT课件.ppt
第16章气相色谱分析仪器16.1气相色谱仪器气路系统、进样系统、柱分离系统、温控系统、各类检测器16.2气相色谱固定相气固色谱固定相(吸附剂)、气液色谱固定相(载体+固定液)16.3气相色谱分离分析条件柱长、载气及其流速、填充颗粒、柱温、进样量及进样方式16.4定性分析保留时间、经验规律、保留指数、双柱定性、仪器联用定性16.5定量分析校正因子、归一化法、外标法、内标法16.6毛细管色谱简介毛细管分类及特点气相色谱过程:待测物样品被蒸发为气体并注入到色谱分离柱柱顶,以惰性气体(指不与待测物反应的气体,只起

在线气相色谱分析仪全面介绍ppt课件.ppt
在线色谱分析仪色谱分离基本原理混合物在色谱柱中的分离过程示意图在线工业色谱测量系统框图气相色谱仪组成气相色谱仪常用的检测器热导池检测器(ThermalConductivityDetector,TCD)火焰离子检测器(flameionizationdetector,FID)火焰光度检测器(FlamePhotometricDetector,FPD)电子捕获检测器(ElectronCaptureDetector,ECD)色谱柱的分类气相色谱仪的载气载气种类的原则色谱仪的谱图及流出曲线典型色谱流出曲线图西门子Ma
