
江苏专用版2020版高考化学总复习专题九第3讲实验方案的设计与评价练习含解析.docx

ca****ng










在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

江苏专用版2020版高考化学总复习专题九第3讲实验方案的设计与评价练习含解析.docx
第3讲实验方案的设计与评价一、单项选择题1.(2018南师大附中模拟)下列实验对应的现象及结论均正确且两者具有因果关系的是()选项实验现象结论A将SO2通入BaCl2溶液,然后滴入稀硝酸产生白色沉淀,白色沉淀不溶于稀硝酸所得沉淀为BaSO3,后转化为BaSO4B酸性硝酸铁溶液中加入几滴碘化钾-淀粉溶液溶液变蓝色说明三价铁离子具有较强氧化性C向FeCl2溶液中加入足量Na2O2粉末出现红褐色沉淀和无色气体FeCl2溶液部分变质D向苯酚中滴加浓溴水溶液酸性明显增强可能发生了取代反应答案DA项,将SO2通入Ba

(江苏专用版)2020版高考化学总复习 专题九 第3讲 实验方案的设计与评价课件.pptx
第3讲实验方案的设计与评价考点一实验方案的设计与评价考点一实验方案的设计与评价(1)实验原理是否正确、可行;(2)实验操作是否安全、合理;(3)实验步骤是否简单、方便;(4)实验效果是否明显等。2.从“绿色化学”视角对实验方案做出评价“绿色化学”要求设计安全的、对环境友好的合成线路,降低化学工业生产过程中对人类健康和环境的危害,减少废弃物的产生和排放。据此,对化学实验过程或方案从以下4个方面进行综合评价:(1)反应原料是否易得、安全、无毒;(2)反应速率是否较快;(3)原料利用率以及生成物质的产率是否较高

(江苏专用版)高考化学总复习 专题九 第3讲 实验方案的设计与评价练习(含解析)-人教版高三全册化学试题.docx
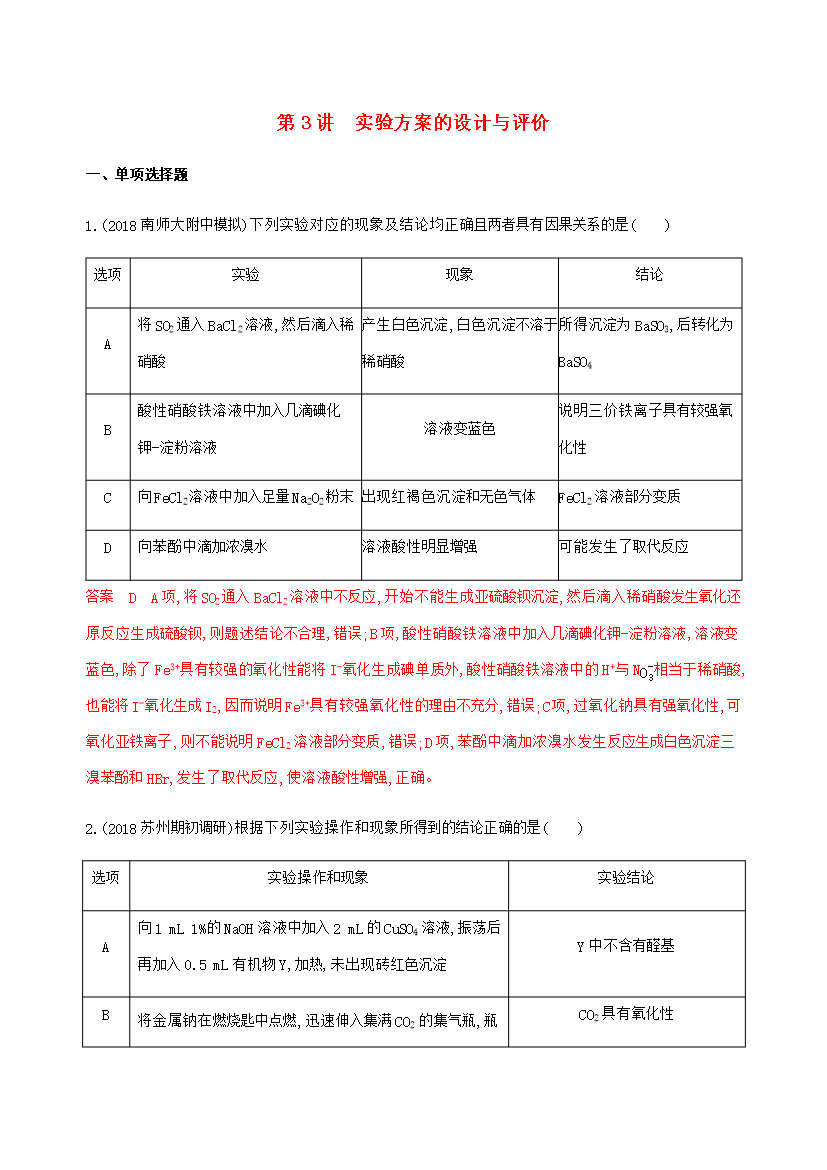
第3讲实验方案的设计与评价一、单项选择题1.(2018南师大附中模拟)下列实验对应的现象及结论均正确且两者具有因果关系的是()选项实验现象结论A将SO2通入BaCl2溶液,然后滴入稀硝酸产生白色沉淀,白色沉淀不溶于稀硝酸所得沉淀为BaSO3,后转化为BaSO4B酸性硝酸铁溶液中加入几滴碘化钾-淀粉溶液溶液变蓝色说明三价铁离子具有较强氧化性C向FeCl2溶液中加入足量Na2O2粉末出现红褐色沉淀和无色气体FeCl2溶液部分变质D向苯酚中滴加浓溴水溶液酸性明显增强可能发生了取代反应答案DA项,将SO2通入Ba
(江苏专用版)高考化学总复习 专题九 第3讲 实验方案的设计与评价练习(含解析)-人教版高三全册化学试题.docx
第3讲实验方案的设计与评价一、单项选择题1.(2018南师大附中模拟)下列实验对应的现象及结论均正确且两者具有因果关系的是()选项实验现象结论A将SO2通入BaCl2溶液然后滴入稀硝酸产生白色沉淀白色沉淀不溶于稀硝酸所得沉淀为BaSO3后转化为BaSO4B酸性硝酸铁溶液中加入几滴碘化钾-淀粉溶液溶液变蓝色说明三价铁离子具有较强氧化性C向FeCl2溶液中加入足量Na2O2粉末出现红褐色沉淀和无色气体FeCl2溶液部分变质D向苯酚中滴加浓溴水溶液酸性明显增强可能发生了取代反应答案DA项将SO2通入B

试题-全国-2019_(江苏专用版)2020版高考化学总复习 专题九 第1讲 化学实验基础练习(含解析).docx
9第1讲化学实验基础一、单项选择题1.下列试剂中,标签上应标注和的是()A.C2H5OHB.HNO3C.NaOHD.HCl答案BC2H5OH不是氧化剂,A项错误;HNO3是强氧化剂,具有强烈的腐蚀性,B项正确;NaOH是强碱,具有强烈的腐蚀性,但不是氧化剂,C项错误;HCl是强酸,具有腐蚀性,但通常不作氧化剂,D项错误。2.下列实验装置操作图不能用于检查气密性的是()答案A用注射器向水中注入空气,导管口一定会有气泡冒出,与检查气密性无关,A项错误;用手握住试管,使试管内空气受热膨胀,即体积增大,若装置气密
