
物质的量在化学实验中的应用省公共课一等奖全国赛课获奖课件.pptx

天马****23









亲,该文档总共25页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

物质的量在化学实验中的应用省公共课一等奖全国赛课获奖课件.pptx
第二节物质量在化学试验中应用物质量特点:对于某浓度溶液,取出任意体积溶液,其浓度、密度、质量分数_____,但所含溶质__________、_____则因体积不一样而改变。【思维诊疗】(正确打“√”,错误打“×”)(1)1L水中溶解5.85gNaCl所形成溶液物质量浓度是0.1mol·L-1。()提醒:×。NaCl溶于水后溶液体积不是1L。(2)标准情况下,22.4LNH3溶于1L水,所得溶液物质量浓度为1mol·L-1。()提醒:×。NH3溶于水后,所得溶液体积不是1L。(3)同浓度三种溶液:Na2SO

化学物质的量在化学实验中的应用省公共课一等奖全国赛课获奖课件.pptx
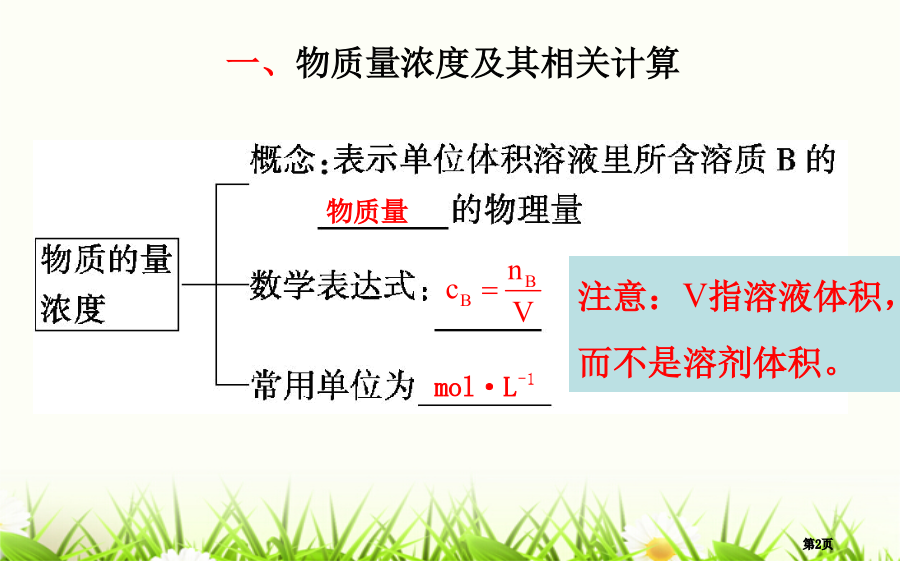
第二节物质量在化学试验中应用一、物质量浓度1.概念:表示单位体积溶液里所含溶质B物质量,符号为cB。[点拨](1)V指溶液体积而不是溶剂体积;(2)取出任意体积1mol·L-1溶液,其浓度都是1mol·L-1。但所含溶质量则因体积不一样而不一样;(3)“溶质”是溶液中溶质,能够是化合物,也能够是离子或其它特定组合,尤其像NH3、Cl2等物质溶于水后成份复杂,但求算浓度时,仍以溶解前NH3、Cl2为溶质,如氨水在计算中使用摩尔质量时,用17g·mol-1。二、一定物质量浓度溶液配制1.主要仪器(1)托盘天平
物质的量在化学实验中的应用误差分析省公共课一等奖全国赛课获奖课件.pptx
托盘天平或量筒、烧杯、玻璃棒、容量瓶、胶头滴管、2、步骤及所用仪器2、步骤及所用仪器2、步骤及所用仪器3、步骤及所用仪器2、步骤及所用仪器2、步骤及所用仪器2、步骤及所用仪器容量瓶规格容量瓶使用注意事项注意问题误差分析:1)称量时左盘高,右盘低2、溶解、转移、洗涤产生误差9)定容时俯视刻度误差分析4、误差分析

物质的量浓度在化学实验中的应用说课省公共课一等奖全国赛课获奖课件.pptx
物质的量在化学实验中的应用24认识到物质间化学反应是肉眼无法观察到分子、原子或离子之间按照一定数目关系进行,也是按照一定质量关系进行,能利用化学语言描述化学反应中定量关系;678活动一步骤二之摩擦力大小五.板书设计

物质的量浓度在化学实验中的应用说课优质课件省公共课一等奖全国赛课获奖课件.pptx
物质的量在化学实验中的应用24认识到物质间化学反应是肉眼无法观察到分子、原子或离子之间按照一定数目关系进行,也是按照一定质量关系进行,能利用化学语言描述化学反应中定量关系;678活动一步骤二之摩擦力大小五.板书设计
