
(天津专用)高考化学一轮复习 专题十九 化学实验基本方法课件-人教版高三全册化学课件精编.pptx

xf****65







亲,该文档总共61页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

(天津专用)高考化学一轮复习 专题十九 化学实验基本方法课件-人教版高三全册化学课件精编.pptx
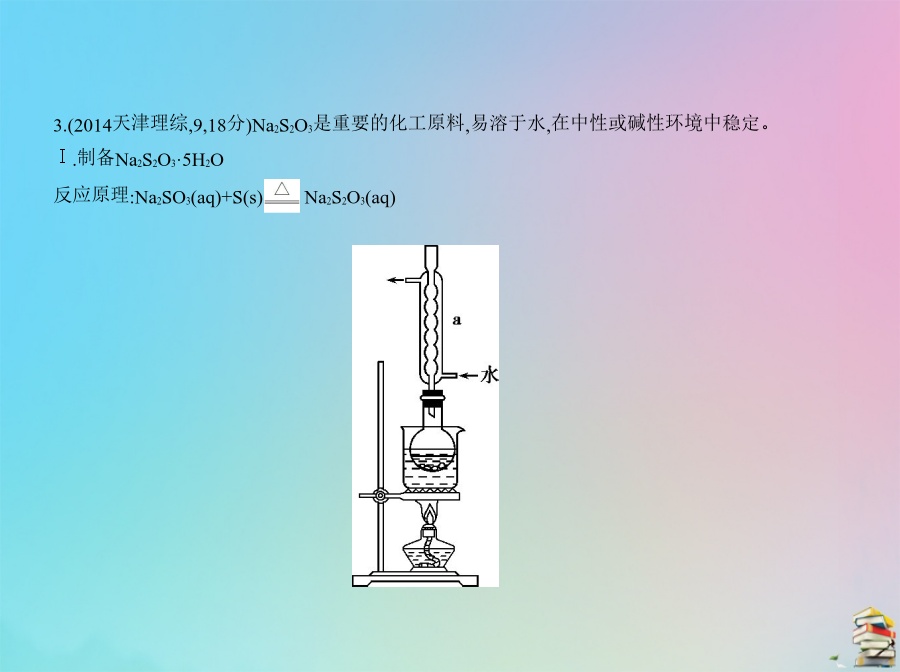
专题十九化学实验基本方法A组自主命题·天津卷题组考点二化学实验的基本操作3.(2014天津理综,9,18分)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。Ⅰ.制备Na2S2O3·5H2O反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)实验步骤:①称取15gNa2SO3加入圆底烧瓶中,再加入80mL蒸馏水。另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中。②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60分钟。③趁热过滤,将滤液水浴加热浓缩,冷却析出Na

(新课标Ⅱ)高考化学一轮复习 专题二十 化学实验基本方法课件-人教版高三全册化学课件精编.ppt
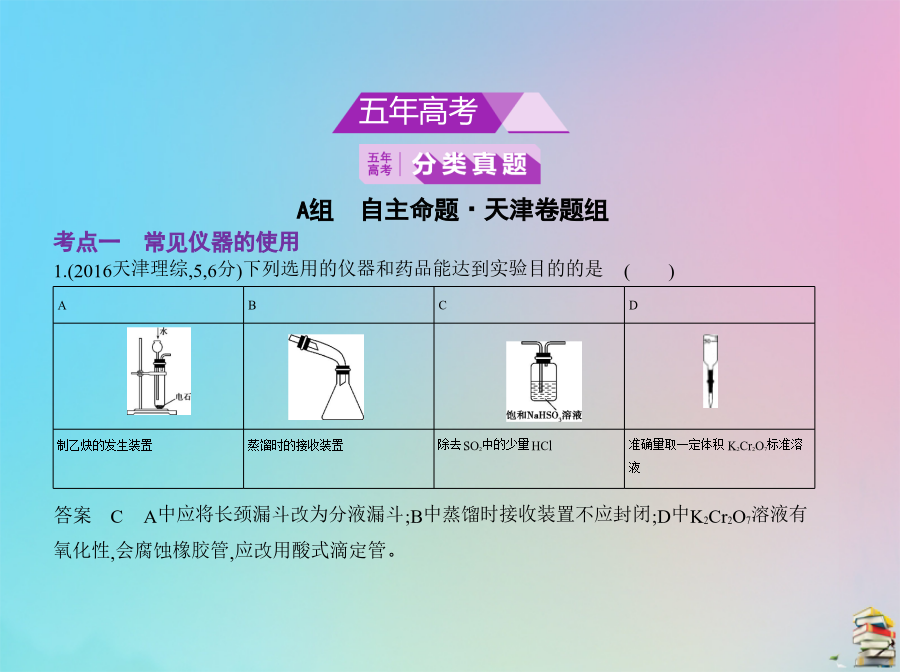
专题二十化学实验基本方法考点一常见仪器的使用(2014课标Ⅰ,12,6分,0.747)下列有关仪器使用方法或实验操作正确的是 ()A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干B.酸式滴定管装标准溶液前,必须先用该溶液润洗C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体答案B容量瓶不能放在烘箱中烘干,否则其容积可能受温度的影响而发生改变,A错误;滴定管在盛放溶液前,必须用所盛溶液润洗2~3次,B正确;中和滴定时,若用待滴定溶液润洗锥形瓶,必

(江苏专用)高考化学一轮复习 专题23 化学实验基本方法课件-人教版高三全册化学课件.pptx
第四部分化学实验基础专题23化学实验基本方法A组自主命题·江苏卷题组答案BA项灼烧碎海带应在坩埚中进行错误;C项用MnO2和浓盐酸制备Cl2需要加热错误;D项吸收尾气中的Cl2要用NaOH溶液不能用饱和NaCl溶液错误。2.(2017江苏单科42分)下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是 () 答案B本题考查化学实验基础知识。A项制取SO2应用Cu和浓H2SO4反应错误;B项SO2能使品红溶液褪色可用品红溶液验证SO2的漂白性正

(江苏专用)高考化学一轮复习 专题16 化学实验基本方法课件-人教版高三全册化学课件.pptx
第五部分化学实验专题16化学实验基本方法考点一常用化学仪器的使用 二、计量仪器b.使用前需⑨检漏;c.溶液转入时要用玻璃棒引流;d.加水至距刻度线1~2cm时改用胶头滴管逐滴加水使溶液凹液面最低点恰好与刻度线水平相切。3.仪器C的名称: 酸式滴定管。a.使用前需 检漏;b.“0”刻度在上方;c.用于盛装酸性溶液或强氧化性液体(如酸性KMnO4溶液)不可装碱性溶液;d.读数精确到 0.01mL。4.仪器D的名称: 碱式滴定管。a.使用前需 检

(山东专用)高考化学一轮复习 专题十九 化学实验基础课件-人教版高三全册化学课件.pptx
专题十九化学实验基础五年高考2.(2012山东理综114分)下列实验操作正确的是 ()A.中和滴定实验时用待测液润洗锥形瓶B.盛放NaOH溶液时使用带玻璃塞的磨口瓶C.用苯萃取溴水中的溴时将溴的苯溶液从分液漏斗下口放出D.NaCl溶液蒸发结晶时蒸发皿中有晶体析出并剩余少量液体即停止加热考点二化学实验的基本操作答案D本题涉及的考点有溴苯的制取与提纯、化学实验的基本方法和技能考查了化学实验与探究能力。通过化学实验体现了科学探究与创新意识的学科核心素养。苯与溴在FeBr3催化下立即反应产生HB
