
随着原子序数的递增学习资料.pptx

快乐****蜜蜂









亲,该文档总共29页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

随着原子序数的递增学习资料.pptx
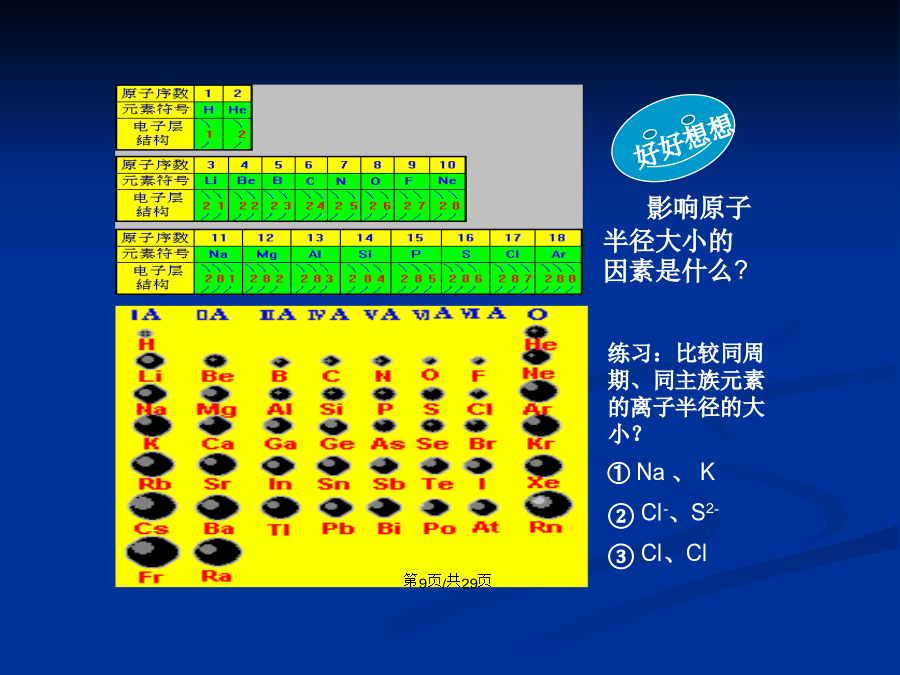
会计学/一、元素周期表的编排原则二、元素周期表的结构二、元素周期表的结构(2)族的分布位置练习与思考:7、下列各表为周期表的一部分(表中为原子序数),其中正确的是()(A)(B)(C)(D)/影响原子半径大小的因素是什么?11Na12Mg13Al14Si15P16S17Cl/P8“活动与探究”P9“问题解决”完成下列各题,利用图1—6表示元素周期表中元素金属性、非金属性的递变规律。1.在图中4个箭号旁的方框中分别用简要的文字说明元素金属性和非金属性的递变规律。2.在图中适当位置写出金属性最强的元素和非金属

随着原子序数的递增.ppt
回顾:随着原子序数的递增,元素原子的核外电子排布元素原子半径元素主要化合价元素的金属性、非金属性一、元素周期表的编排原则二、元素周期表的结构二、元素周期表的结构(2)族的分布位置练习与思考:7、下列各表为周期表的一部分(表中为原子序数),其中正确的是()(A)(B)(C)(D)影响原子半径大小的因素是什么?11Na12Mg13Al14Si15P16S17Cl预测同主族元素的性质P8“活动与探究”P9“问题解决”完成下列各题,利用图1—6表示元素周期表中元素金属性、非金属性的递变规律。1.在图中4个箭号旁的

回顾随着原子序数的递增元素原子的核外电子排布元素原子半径元素.ppt
元素周期表回顾随着原子序数的递增元素原子的核外电子排布元素原子半径元素主要化合价NaMgAlSiPSCl判断依据Na11钠元素周期表He2氦元素周期表的结构元素周期表的结构其它周期表其它周期表其它周期表其它周期表练习与思考:练习与思考:练习与思考:元素性质的递变规律1练习1原子结构比较微粒半径大小的规律练习2元素周期律及元素周期表的三大意义练习3练习4练习5

烷烃同系物随着分子中碳原子数的递增熔点.ppt
脂肪烃的性质2、脂肪烃的化学性质甲烷的化学性质乙烯的化学性质:乙炔的化学性质:烷烃的化学性质:烯烃、炔烃的化学性质①1,2加成答案:(1)DC答案:(1)C10H20(2)AG(3)4种再见!

根据图像思考随着核电荷数的递增原子半径有什么样的变化规律.pptx
