
氧化还原反应上课课件学习.pptx

快乐****蜜蜂









亲,该文档总共39页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

氧化还原反应上课课件学习.pptx
会计学失电子(或电子对偏离)MnO2+4HCl=MnCl2+Cl2↑+2H2O四、氧化剂和还原剂(2)氧化产物和还原产物氧化反应(化合价升高)的产物叫做氧化产物;还原反应(化合价降低)的产物叫做还原产物。判断下列反应是否属于氧化还原反应,并指出氧化剂和氧化产物、还原剂和还原产物。2、火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S=K2S+N2↑+3CO2↑其中被氧化的元素是,被还原的元素是,氧化剂是,还原剂是,氧化

氧化还原反应上课.ppt
第二章化学物质及其变化复习:上节课我们根据反应中是否有离子参加,将化学反应分为离子反应和非离子反应,思考离子反应发生的条件是什么?H2+CuO==Cu+H2O思考与交流4.是否只有得失氧的反应才是氧化还原反应?+2从化合价升降观点分析氧化还原反应从化合价升降观点分析氧化还原反应2.H2+Cl2==2HCl练习3:分析化合价变化的情况,说明反应中的电子得失。学会比较,学会总结四种基本反应类型与氧化还原反应的关系课堂练习

氧化还原反应lxl上课用.ppt
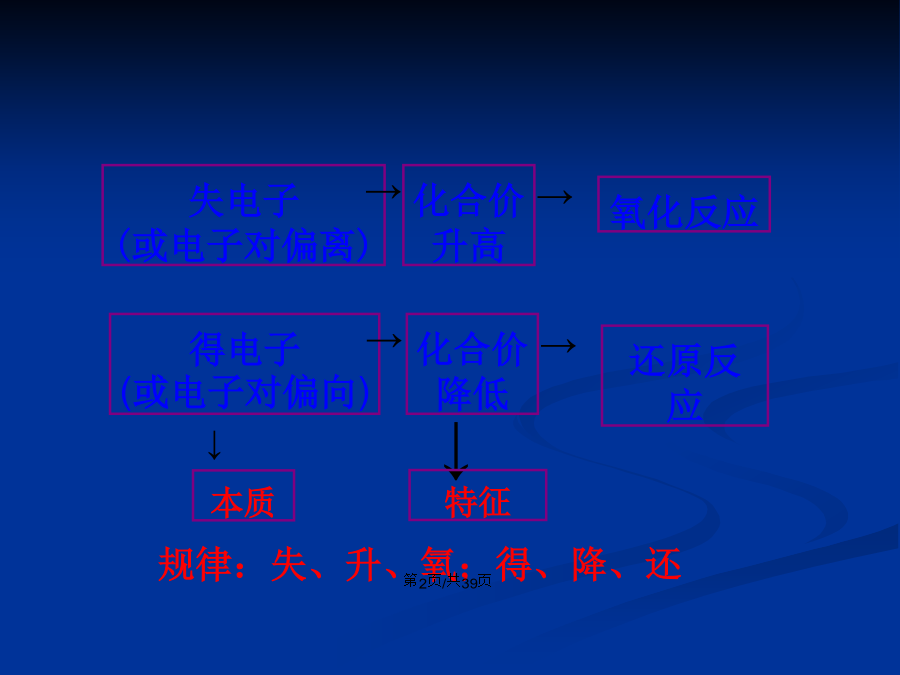
氧化还原反应高温思考与交流1:分组讨论:氧化反应和还原反应是分别独立进行的吗?为什么?请分析下列3个氧化还原反应中各种元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价的升降有什么关系。【归纳总结】1.氧化还原反应的概念(1)氧化反应是物质所含元素化合价________的反应,还原反应是物质所含元素化合价________的反应。(2)氧化还原反应是凡有元素化合价___________的化学反应。非氧化还原反应是凡_____化合价升降的化学反应。2.氧化还原反应的特征氧化还原反应的特征是元素的化合

氧化还原反应的类型15298学习课件.pptx
会计学氧化还原反应的实质是电子的得失或电子对的偏移。根据反应中电子转移的特点,可以将氧化还原反应分为五类:(1)一般的氧化还原反应例如:MnO2+4HCl(浓)=2MnCl2+Cl2↑+2H2O特点:反应过程中电子转移发生在同种物质、同种价态的同种元素之间。(4)归中反应同种元素发生氧化还原反应时,化合价只靠近不交叉。(5)自身氧化还原反应小结:五种反应类型的关系

上课用氧化还原反应的规律及应用.ppt
氧化还原反应的规律及应用一、价态规律:(1)价态与性质规律1、铁元素有多种价态,Fe3+、Fe2+、Fe的氧化性、还原性如何?2、下列微粒不具有氧化性的是()A.Cl2B.Cl-C.H+D.ClO-3、试从化合价角度分析下列粒子的性质。在Fe3+、Fe2+、Al3+、H+、S、Cl-等粒子中只有氧化性的是_______________,只有还原性的是________,兼有氧化性和还原性的是_________。已知:氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,试据此判断下列四种化合物:①NO②
