
锌焙砂酸浸出热力学.ppt

天马****23









亲,该文档总共25页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

锌焙砂酸浸出热力学.ppt
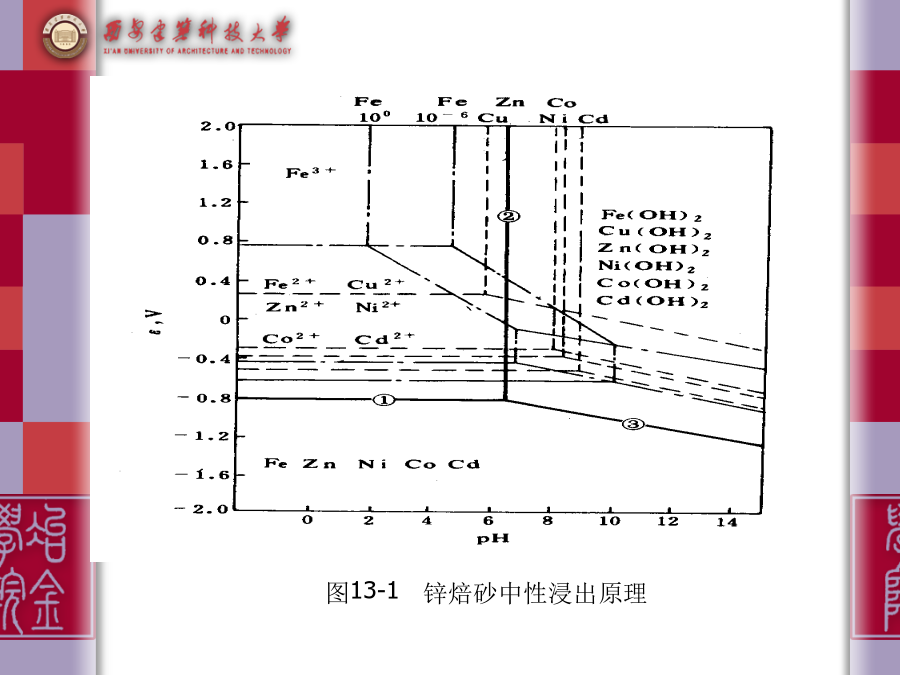
第十三章矿物浸出目录13.1概述从冶金原理的观点来看,浸出的分类应按浸出过程主要反应(即有价成分转入溶液的反应)的特点划分为当,如此,可将浸出分为三大类:13.2浸出反应的热力学锌焙砂中性浸出原理:由图可以看出:当锌离子浓度为1.988mol·L-1时,开始从溶液中沉淀析出锌的pH值为6.321;沉淀析出的pH值比锌离子小的溶液中只有三价铁离子;铜离子的析出pH值与锌离子相近。因此,当中性浸出终点溶液的pH值控制在5.2~5.1之间时,三价铁离子就以氢氧化铁沉淀析出。溶液中的铜在活度较大的情况下,会有一部

锌焙砂浸出制备铁酸锌研究.docx
锌焙砂浸出制备铁酸锌研究一、引言锌焙砂是含锌较高的烟囱渣或窑炉渣,由于其含有一定的硫酸和氯化物等化学成分,对于环境造成的污染较大,如何有效地减少其对环境的影响,并实现对其中锌的回收利用一直是工业界和学术界的一个研究热点。铁酸锌是一种重要的锌盐,具有广泛的工业应用价值,其制备一般是通过锌焙砂中锌的浸出获取。二、锌焙砂浸出技术研究1.生石灰法锌焙砂浸出法该方法是将锌焙砂与生石灰混合后进行加热,使其溶解,加入水后,锌酸钙沉淀,再通过通入二氧化碳气体使锌酸钙转化为氢氧化锌,过滤即可得到纯度较高的锌;但该方法存在废

锌焙砂硫酸浸出及制取铁酸锌试验研究.docx
锌焙砂硫酸浸出及制取铁酸锌试验研究摘要本文研究了锌焙砂的硫酸浸出及制取铁酸锌的试验方法和过程。首先对锌焙砂进行了化学分析,确认了锌含量较高,难度较大。在浸出实验中,采用硫酸作为浸出剂,考察了不同浸出条件对浸出效率的影响,并分析了硫酸浸出机理。最后,通过对浸出液的进一步处理,利用沉淀法制取了铁酸锌,并对其进行了分析测试。结果表明,硫酸浸出法可以高效地提取锌焙砂中的锌,制备的铁酸锌品质良好。关键词:锌焙砂;硫酸浸出;铁酸锌;制备一、引言铁酸锌是一种重要的无机化合物,具有许多应用领域。例如,在电子工业中,铁酸锌

锌焙砂浸出规律研究.docx
锌焙砂浸出规律研究锌焙砂(ZincRoasting)是指通过加热锌矿,使其中的硫化物转化为氧化物、硫酸盐等,从而使锌得到浸出。由于锌焙砂浸出的过程涉及多种化学反应、传质过程,其中规律及机理研究对加强锌冶炼技术的发展至关重要。在锌焙砂浸出过程中,主要的化学反应包括锌氧化、硫酸盐水解反应、碱式硫酸盐浸出等。其中,锌氧化反应是最基础的反应之一,其反应式为:ZnS+3/2O2=ZnO+SO2↑锌氧化反应是锌焙砂浸出过程的起点,锌矿中的硫化物在高温下氧化转化为氧化物。随后,氧化锌在稀硫酸溶液中水解成成硫酸盐和氢氧化

锌焙砂中性浸出原理.ppt
第十三章矿物浸出目录13.1概述从冶金原理的观点来看,浸出的分类应按浸出过程主要反应(即有价成分转入溶液的反应)的特点划分为当,如此,可将浸出分为三大类:13.2浸出反应的热力学锌焙砂中性浸出原理:由图可以看出:当锌离子浓度为1.988mol·L-1时,开始从溶液中沉淀析出锌的pH值为6.321;沉淀析出的pH值比锌离子小的溶液中只有三价铁离子;铜离子的析出pH值与锌离子相近。因此,当中性浸出终点溶液的pH值控制在5.2~5.1之间时,三价铁离子就以氢氧化铁沉淀析出。溶液中的铜在活度较大的情况下,会有一部
