
铁和铁的重要化合物.ppt

yy****24





亲,该文档总共40页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

铁和铁的重要化合物.ppt
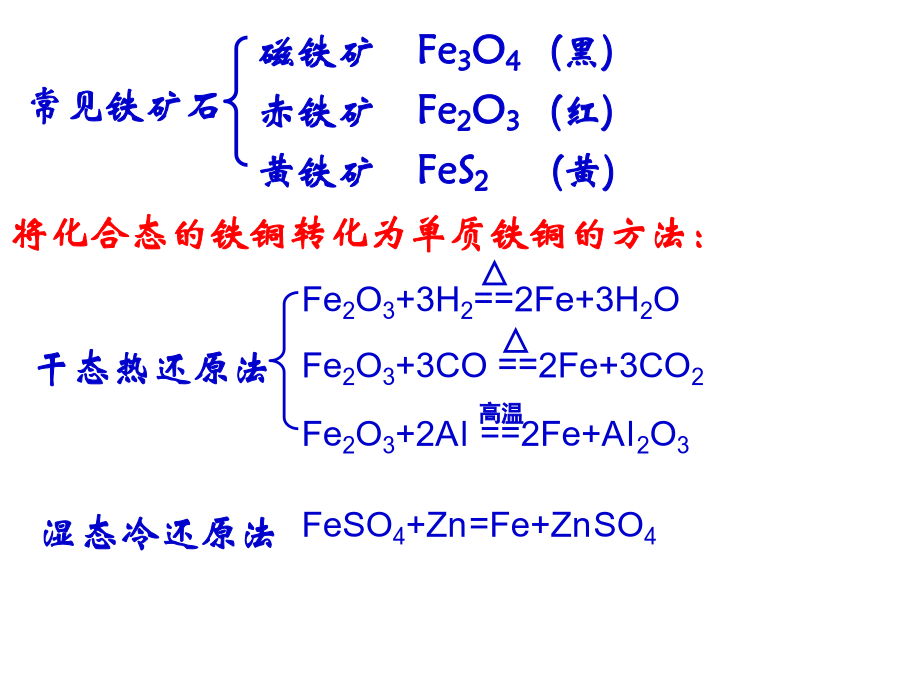
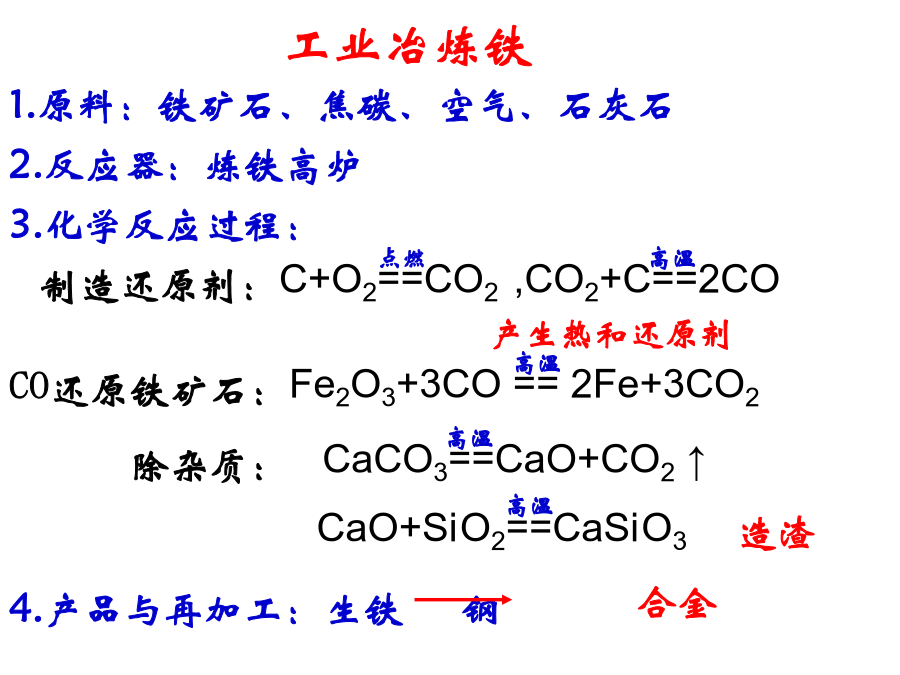
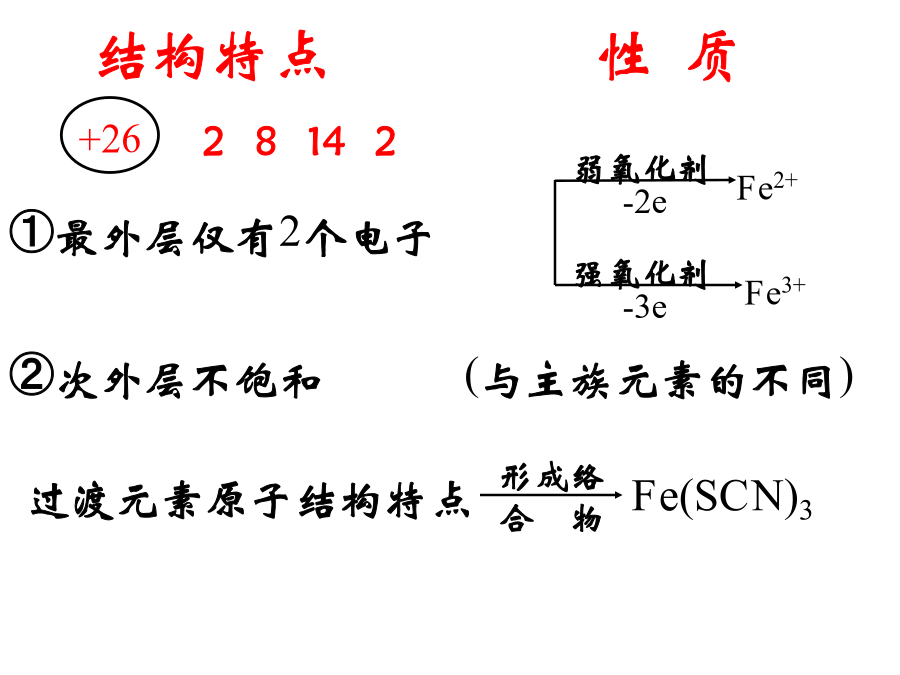
高三化学专题复习第四周期,第Ⅷ族。是过渡元素的代表。常见铁矿石1.原料:铁矿石、焦碳、空气、石灰石1.银白色,有金属光泽,质软;二.铁的化学性质①最外层仅有2个电子1.与非金属反应:3Fe+2O2===Fe3O43.铁与水的反应Fe+6HNO3(浓)==Fe(NO3)3+3NO2↑+3H2O铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为()A.Fe(OH)2;FeOB.Fe(OH)3;Fe2O3C.

铁的重要化合物.ppt
日本横滨弯钢索斜拉大桥第三章金属及其化合物黄铁矿(FeS2)名称用途:FeO+2H+=Fe2++H2O若将NaOH溶液滴加到FeCl3溶液中有什么现象?若滴加到FeCl2溶液中呢?请同学们写出相应的化学方程式。名称制法若向FeCl3溶液中加入过量的铁粉会有什么现象?请同学们写出相应的化学方程式。用FeCl3溶液可以腐蚀印刷线路板,请解释并写出离子方程式。若想从废液中回收铜,应如何操作?Fe2+4.Fe3+的检验如何检验Fe2+呢?5.Fe2+和Fe3+鉴别方法缺铁性贫血的补血药物“维C和Fe搭档效果会更好

铁的重要化合物.doc
铁的重要化合物京山二中杨方泽一、三维目标1、知识与技能①了解铁的氧化物的性质和应用。②掌握铁的氢氧化物的制备和性质。③Fe2+和Fe3+的鉴别方法。④通过实验培养学生观察、动手和分析综合能力2、过程与方法在“大胆推测→设计实验→实验验证→得出结论→解决实际问题”过程中,学习知识、体验科学研究过程。3、情感、态度、价值观通过学习,让学生体验科学探究成功的喜悦;培养他们的探究意识和合作精神。二、教学重点、难点:重点:铁的氢氧化物的制备+2价和+3价铁的化合物的性质三、教学过程【新课引入】通过FeCl3与KSC

铁的重要化合物.ppt
第3课时铁的重要化合物1、了解铁的重要化合物的主要性质及应用。2、掌握检验Fe3+、Fe2+的方法及相互转化。3、了解Fe(OH)3、Fe(OH)2的制备方法,四氧化三铁化学式名称(1)在溶液上加入保护层(如植物油)三.铁盐和亚铁盐鉴别方法FeCl3溶液Fe1、现榨的苹果汁在空气中会由绿色变为棕黄色,其原因可能是()A、苹果汁中的Fe2+变成Fe3+B、苹果汁含有Cu2+C、苹果汁含有OH-D、苹果汁含有Na+2、为了检验某FeCl2溶液是否变质,可以向溶液中加()A、NaOH溶液B、铁片C、KSCN溶液

铁的重要化合物.ppt
第三章金属及其化合物铁是人体内需要的微量元素。一般人的体内含铁量为4.2~6.1g,相当于一个小铁钉的重量,约占人体体重的0.004%,血红蛋白中的铁是体内氧的输送者。1、铁的氧化物名称方案一:能否通过铁和水反应制得?方案二:能否通过铁的氧化物和水反应得到?方案三:用可溶性铁盐、亚铁盐与碱溶液反应?铁的氢氧化物——制备氢氧化铁和氢氧化亚铁Fe(OH)3Fe(OH)2实验3-9:用一支试管取2mLFeSO4溶液,使用胶头滴管向其中加入少量NaOH溶液,观察现象。用下面方法可以制得白色的Fe(OH)2沉淀方法
