
氧化还原反应讲课用.ppt

wt****58









亲,该文档总共26页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

氧化还原反应讲课用.ppt
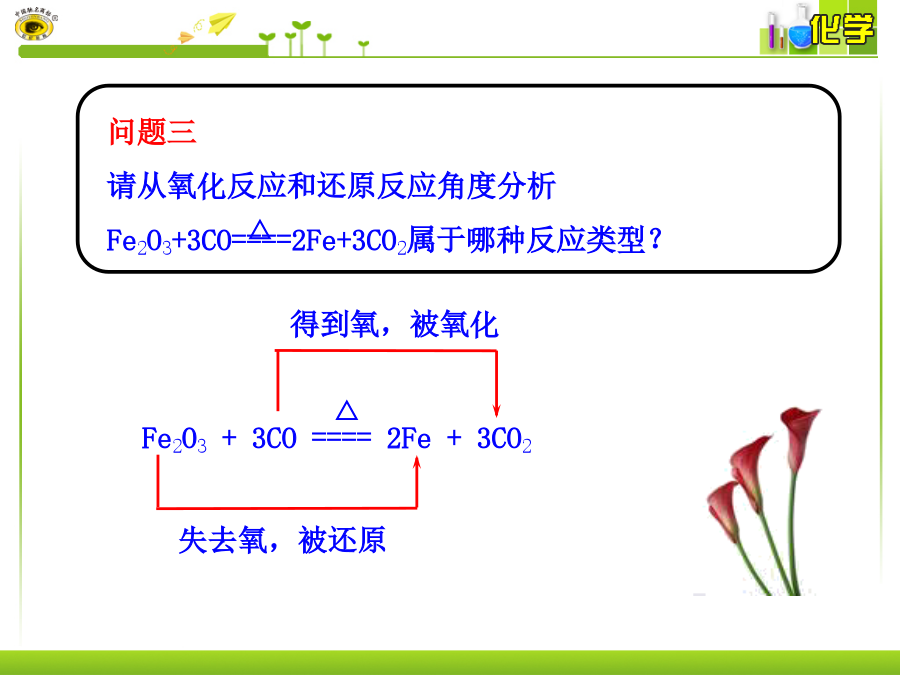
授课人:王羽锋华夏职校2012.11.21第三节氧化还原反应感受氧化还原反应的存在刚泡好的绿茶感受氧化还原反应的存在感受氧化还原反应的存在得到氧,被氧化氧化反应:物质得到氧原子的反应还原反应:物质失去氧原子的反应标出下列氧化还原反应中的各个元素的化合价,观察化合价有无变化,变化有何规律?氧化反应,化合价升高从化合价升降的角度来分析:氧化反应即为化合价升高的反应;还原反应即为化合价降低的反应。Zn+2HCl====ZnCl2+H2↑从化合价升降的角度定义有元素化合价升降的反应,叫氧化还原反应。判断方法:根据

讲课氧化还原反应.ppt
一、氧化还原反应的基本概念2Al+Fe2O32Fe+Al2O3试判断下列元素所处价态的氧化性、还原性:生活中的氧化还原反应精选课件生活中的氧化还原反应(一)精选课件精选课件精选课件一、部分氧化还原反应在氧化还原反应中,如果还原剂只有部分被氧化、或者氧化剂只有部分被还原,这就是部分氧化还原反应.二、歧化反应同种物质中同种价态的同种元素一部分被氧化、一部分被还原的反应称为歧化反应三、归中反应不同价态的同一元素化合价可升高或降低至某一中间价态。同种元素不同价态之间发生氧化还原反应遵循以下归中规律:高价+低价→

(讲课)氧化还原反应1.ppt
第三节氧化还原反应介休一中刘秀清⑥NaOH+HCl==NaCl+H2O得氧,被氧化(发生氧化反应)⑥NaOH+HCl==NaCl+H2O化合价变化本质原因的分析:以NaCl为例氧化还原的本质定义:〖练习〗判断下列哪些是氧化还原反应?是氧化还原反应的标出电子转移的方向与数目。自然界的某元素X多以单质、低价(-1、-2)化合物形式存在,可工业上大量需要它的高价(+4、+6)化合物作为原料,你认为应该如何获得这些物质?谢谢!⑦NaOH+HCl==NaCl+H2O拉瓦锡(1743、8----1794、5)法国著名

化学氧化还原反应的讲课稿.docx
化学氧化还原反应的讲课稿化学氧化还原反应的讲课稿一、说教材1.教材的地位和作用“氧化还原反应”是人教版高一化学新教材第二章第三节的内容。对于氧化氧化还原反应,在中学新课程体系中是分三阶段完成的:在初中阶段从得氧失氧的角度分析理解;在化学必修1中要求在初中化学的基础上,能用化合价升降和电子转移的观点来初步理解氧化还原反应以及了解常见的氧化剂和还原剂即可;通过后续课程如金属及其化合物及非金属及其化合物的学习,对氧化还原反应有了更多更具体的认识后再要求学生深入理解氧化还原反应的有关知识。本节课的教学处于第二阶段

3好讲课氧化还原反应.ppt
一、氧化还原反应的基本概念2Al+Fe2O32Fe+Al2O3试判断下列元素所处价态的氧化性、还原性:精选课件精选课件精选课件生活中的氧化还原反应精选课件生活中的氧化还原反应(一)精选课件帘外芭蕉惹骤雨门环惹铜绿一、部分氧化还原反应在氧化还原反应中,如果还原剂只有部分被氧化、或者氧化剂只有部分被还原,这就是部分氧化还原反应.二、歧化反应同种物质中同种价态的同种元素一部分被氧化、一部分被还原的反应称为歧化反应三、归中反应高价+低价→相同中间价(注“可靠拢、不交叉”)反馈练习:1、在KClO3+6HCl=K
