
第二章晶体结构结合力和结合能.ppt

和蔼****娘子






亲,该文档总共35页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料
第二章晶体结构结合力和结合能.ppt
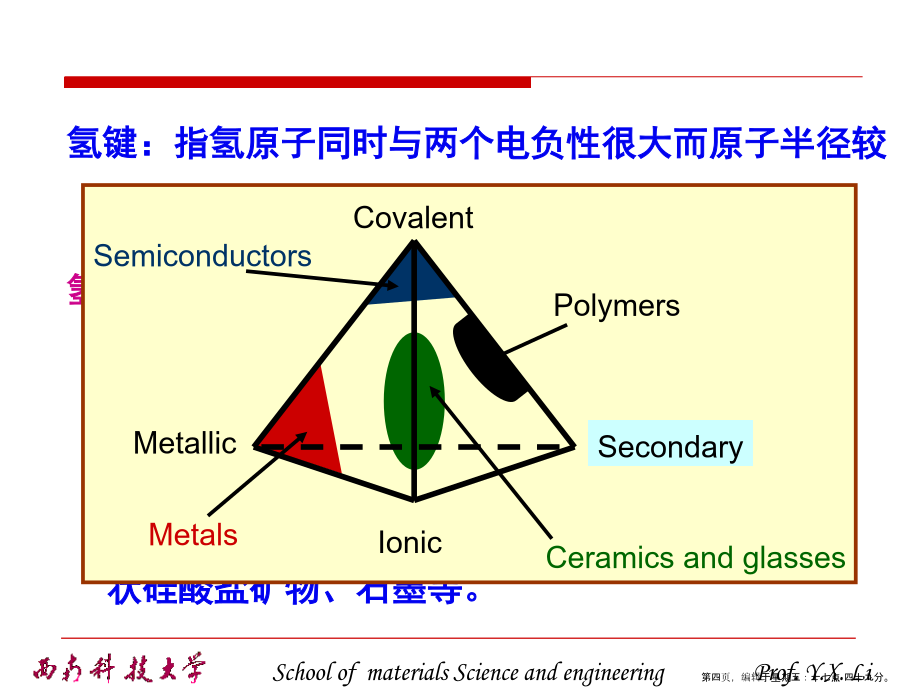
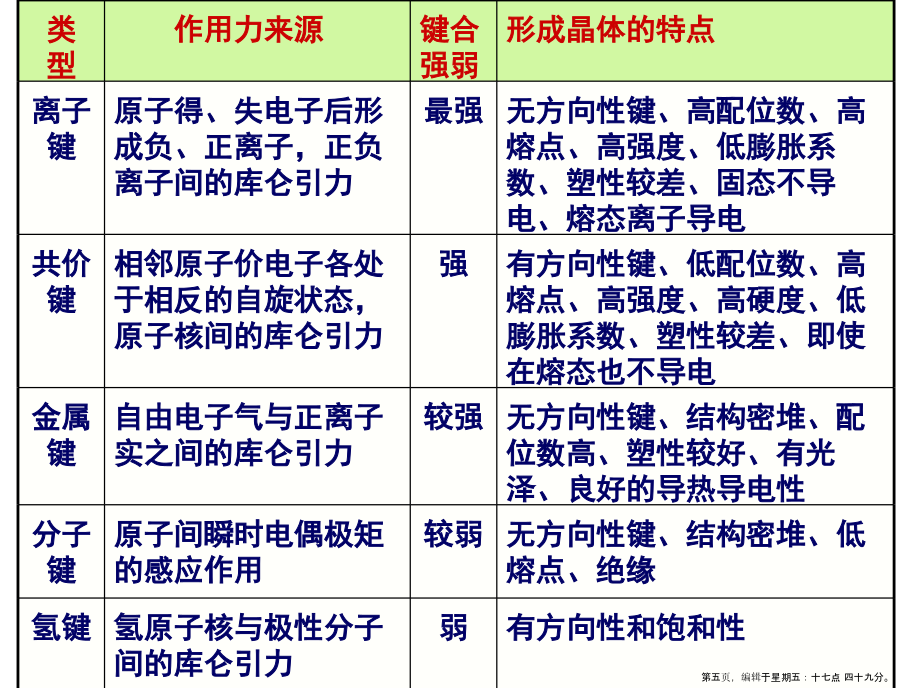
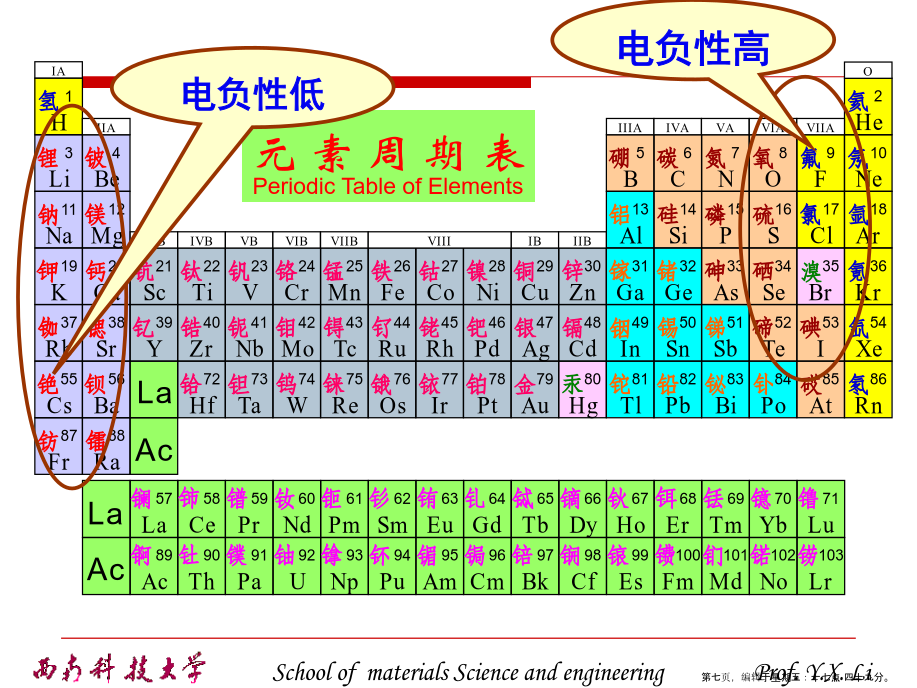
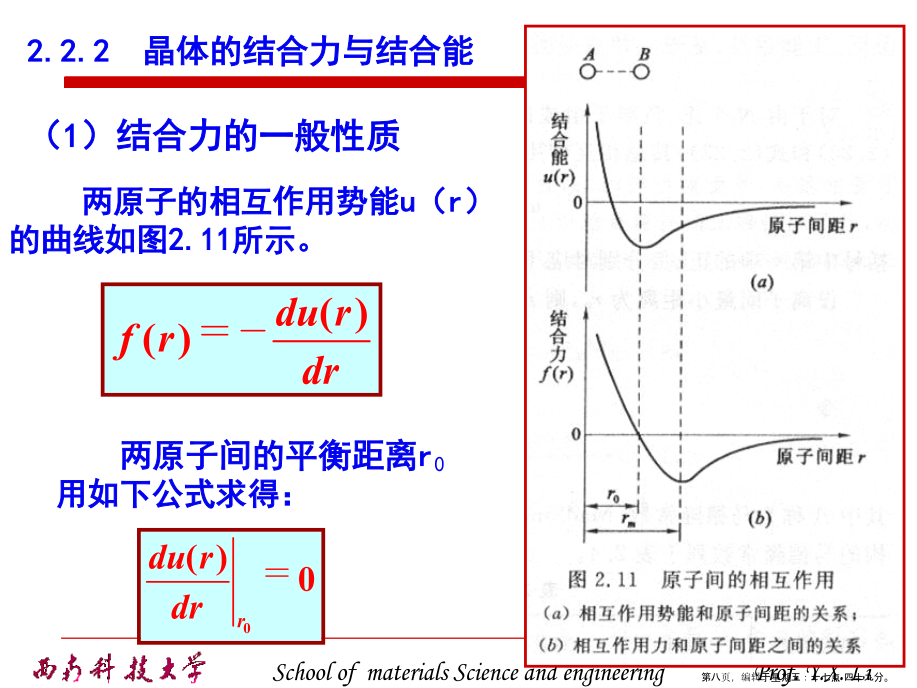
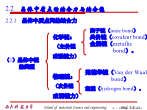
2.2晶体中质点的结合力与结合能离子键:正、负离子依靠静电库仑力而产生的键合。离子键的特点是没有方向性和饱和性。范德华键(分子键):通过“分子力”而产生的键合。氢键:指氢原子同时与两个电负性很大而原子半径较小的原子(O、N、F等)相结合所形成的键。氢键具有饱和性和方向性类型(2)晶体中离子键、共价键比例的估算2.2.2晶体的结合力与结合能(1)结合力的一般性质有效引力最大时,两原子间的距离rm由下式确定:(2)离子晶体的晶格能晶体的结合能Eb:组成晶体的N个原子处于“自由”状态时的总能量EN与晶体处于稳定

固体结合力结合能与材料性能关系.ppt
第二章固体的结合力、结合能与材料性能的关系固体材料内的结合力、结合能虽然可以用量子力学的方法近似地进行计算,但这种方法比较复杂,为了简便,通常对离子晶体直接用静电学方法处理,其他晶体材料则可在离子晶体的基础上做适当修正。静电学处理方法的基本出发点是把正负离子看成离子晶体中的基本荷电质点。由于离子中的电子云一般是满壳层的,因此可假定正负离子的电子云分布是球形对称的。这样在计算时可以不考虑各个离子内部的结构,而将各个离子看作是电荷集中于球心的圆球。2.1双原子(离子)间的结合力和结合能当两个离子靠近时,它们

2-固体的结合力结合能与材料性能的关系.ppt
第二章固体的结合力、结合能与材料性能的关系固体材料内的结合力、结合能虽然可以用量子力学的方法近似地进行计算,但这种方法比较复杂,为了简便,通常对离子晶体直接用静电学方法处理,其他晶体材料则可在离子晶体的基础上做适当修正。静电学处理方法的基本出发点是把正负离子看成离子晶体中的基本荷电质点。由于离子中的电子云一般是满壳层的,因此可假定正负离子的电子云分布是球形对称的。这样在计算时可以不考虑各个离子内部的结构,而将各个离子看作是电荷集中于球心的圆球。2.1双原子(离子)间的结合力和结合能(2-56)当两个离子

核力和结合能.ppt
§19.5核力与结合能核力:能够把核中的各种核子联系在一起的强相互作用力叫做核力.·能够把原子核中的各种核子联系在一起的强大的力,叫做核力。1.万有引力:引力主要在宏观和宇宙尺度上“独领风骚”。是引力使行星绕恒星转动,并且联系着星系团,决定了宇宙的现状和未来。核力与四种基本相互作用1、自然界中稳定核的质子数和中子数有何特点?这个现象如何解释?2、若不断增大原子核的中子数,能不断增大原子核吗?为什么?3、将一个质子和中子结合在一起,会产生什么现象?若要把它们分开,需要什么条件?4、结合能是原子具有的能量吗?

第二章晶体结构与常见晶体结构类型 ppt.pptx
第二章晶体结构与常见晶体结构类型晶态结构示意图3晶体结构用表示所有得点阵点。(3)晶胞:晶体结构得基本重复单元称为晶胞、若晶体有完全相同得一种原子组成,则结构基元就只有一个原子,点阵点得位置即就是这种原子得位置,由这种原子构成得点阵即就是布拉菲点阵。布拉菲点阵得特点:①每个结点周围得情况都就是一样得。②如果晶体就是由完全相同得一种原子组成,则这种原子所围成得网格也就就是布拉菲点阵或布拉菲格子,与结点组成得网格完全相同。复式格子得特点复式格子就是由若干相同得布拉菲格子相互位移套构而成。大家有疑问的,可以询问
