
第 2 章 电势-pH图在.ppt

kp****93





亲,该文档总共28页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

第 2 章 电势-pH图在.ppt
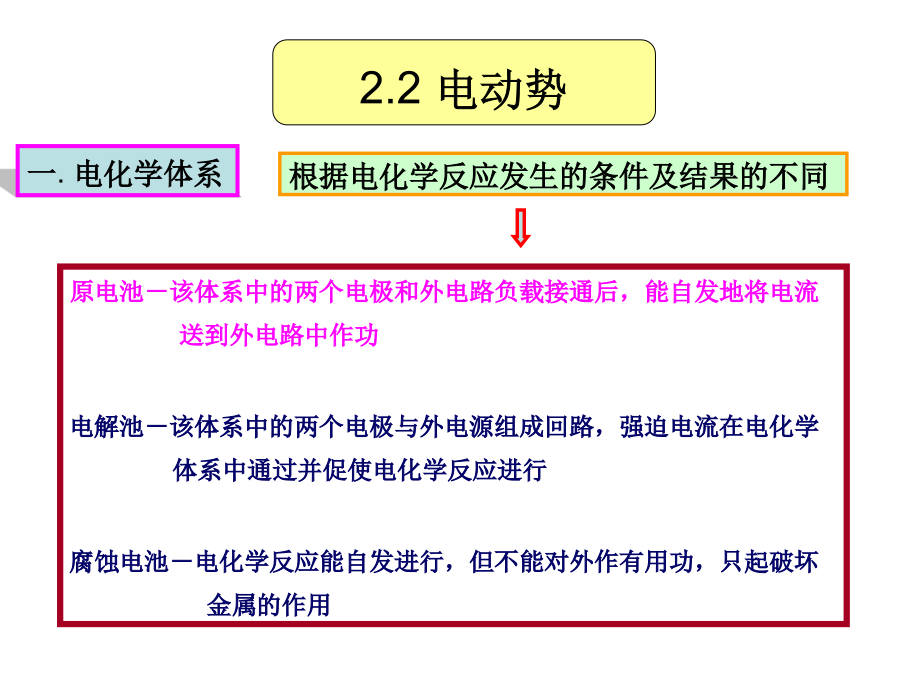
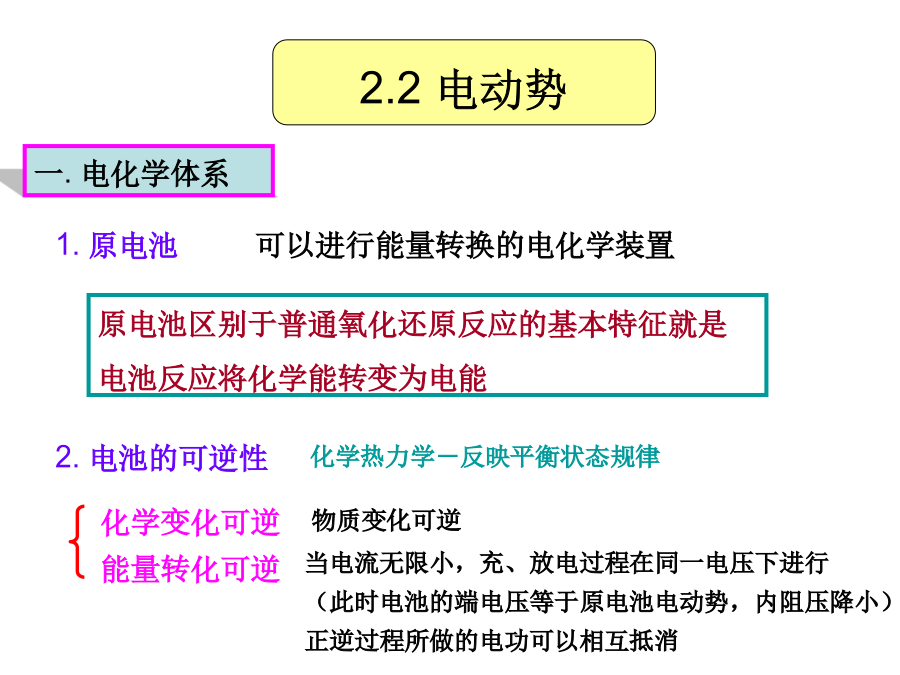
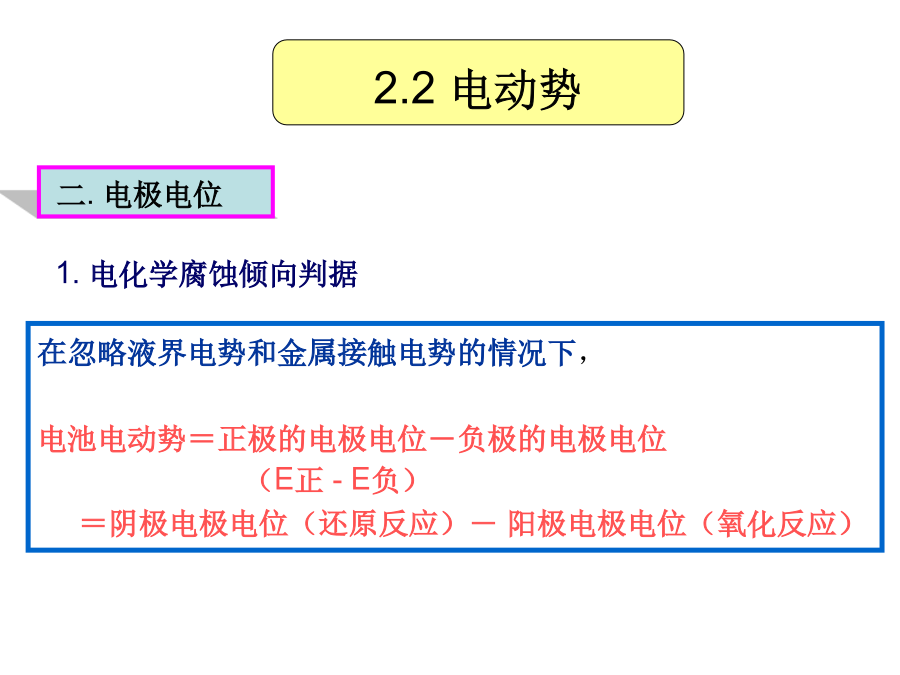
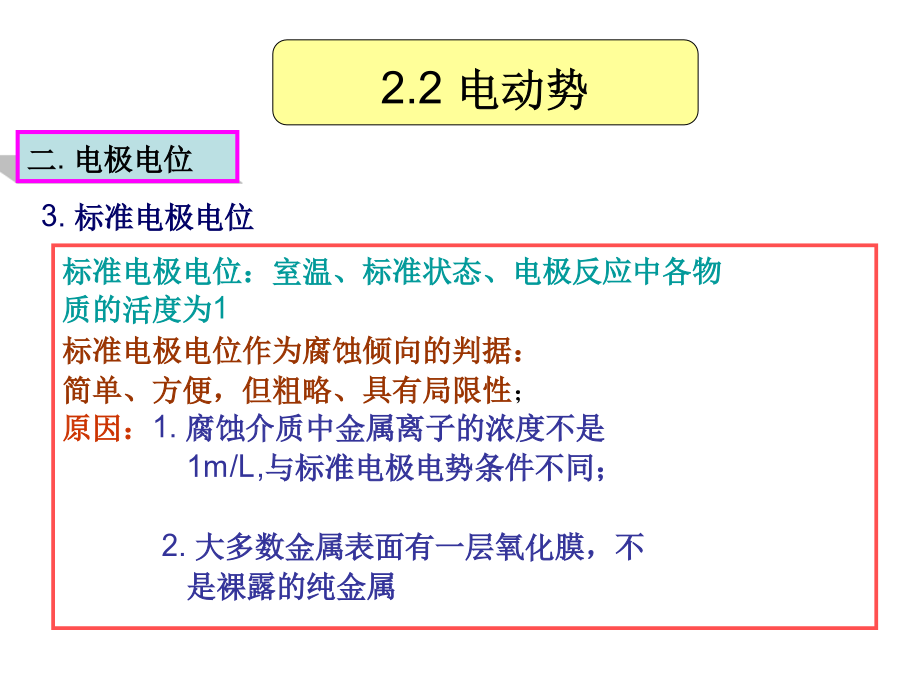
第2章电势-pH图在金属腐蚀中的应用1.腐蚀的热力学过程、腐蚀判据2.电极电位来源电势-pH图的建立及作用腐蚀电池的组成及意义2.1腐蚀过程热力学判据2.2电动势一.电化学体系电动势:可逆条件下(电池中没有电流通过时),电池两端电位差E原电池的能量来源于电池内部的化学反应,原电池反应可逆进行时所做的电功W=QE(电功=电量×电动势)W=QE=nFE(根据法拉第定律)从化学热力学知:恒温恒压下,可逆过程所做的最大有用功等于体系自由能的减少。W=-G2.2电动势在忽略液界电势和金属接触电势的情况下,电池电动

第--章-电势pH图在优秀文档.ppt
第2章电势-pH图在金属腐蚀中的应用1.腐蚀的热力学过程、腐蚀判据2.电极电位来源电势-pH图的建立及作用腐蚀电池的组成及意义1把铁的电极电势降低至免蚀区,即对铁施行阴极保护。肉眼可见,阴极、阳极长时间保持稳定。简单、方便,但粗略、具有局限性;阻止界面附近溶液中的水化Zn离子脱水化而沉淀的作用为了使铁免于腐蚀,可设法将其移出腐蚀区。(2)阴阳极之间要有电性连接(电子导体通道)电池反应将化学能转变为电能标准电极电位:室温、标准状态、电极反应中各物金属/溶液界面上,对Zn离子存在两种矛盾一组与离子浓度有关的斜

电势-PH图.doc
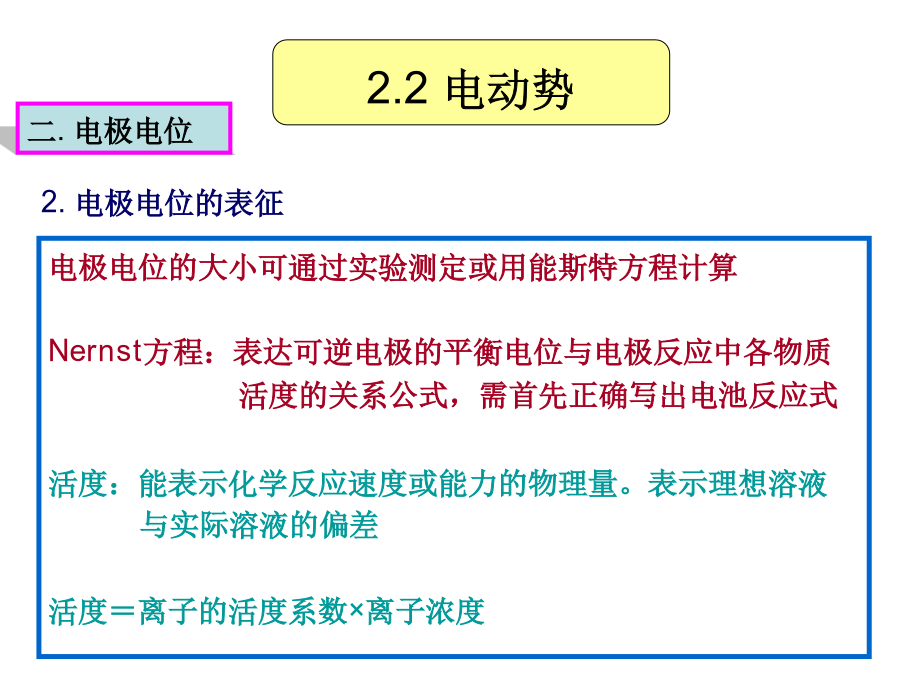
电势—pH曲线的测定测定Fe3/Fe2+-EDTA体系的电势—pH图,掌握测量原理和pH计的使用方法。[原理]标准电极电势的概念被广泛应用于解释氧化还原体系之间的反应。但是很多氧化还原反应的发生都与溶液的pH值有关,此时,电极电势不仅随溶液的浓度和离子强度变化,还要随溶液pH值而变化。对于这样的体系,有必要考查其电极电势与pH的变化关系,从而能够得到一个比较完整、清晰的认识。在一定浓度的溶液中,改变其酸碱度,同时测定电极电势和溶液的pH值,然后以电极电势对pH作图,这样就制作出体系的电势-pH曲线,

电势-PH图.doc
电势—pH曲线的测定测定Fe3/Fe2+-EDTA体系的电势—pH图,掌握测量原理和pH计的使用方法。[原理]标准电极电势的概念被广泛应用于解释氧化还原体系之间的反应。但是很多氧化还原反应的发生都与溶液的pH值有关,此时,电极电势不仅随溶液的浓度和离子强度变化,还要随溶液pH值而变化。对于这样的体系,有必要考查其电极电势与pH的变化关系,从而能够得到一个比较完整、清晰的认识。在一定浓度的溶液中,改变其酸碱度,同时测定电极电势和溶液的pH值,然后以电极电势对pH作图,这样就制作出体系的电势-pH曲线,

电势-PH图0.doc
电势—pH曲线的测定测定Fe3/Fe2+-EDTA体系的电势—pH图,掌握测量原理和pH计的使用方法。[原理]标准电极电势的概念被广泛应用于解释氧化还原体系之间的反应。但是很多氧化还原反应的发生都与溶液的pH值有关,此时,电极电势不仅随溶液的浓度和离子强度变化,还要随溶液pH值而变化。对于这样的体系,有必要考查其电极电势与pH的变化关系,从而能够得到一个比较完整、清晰的认识。在一定浓度的溶液中,改变其酸碱度,同时测定电极电势和溶液的pH值,然后以电极电势对pH作图,这样就制作出体系的电势-pH曲线,
