
离子键价键理论.ppt

kp****93








亲,该文档总共47页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

离子键价键理论.ppt
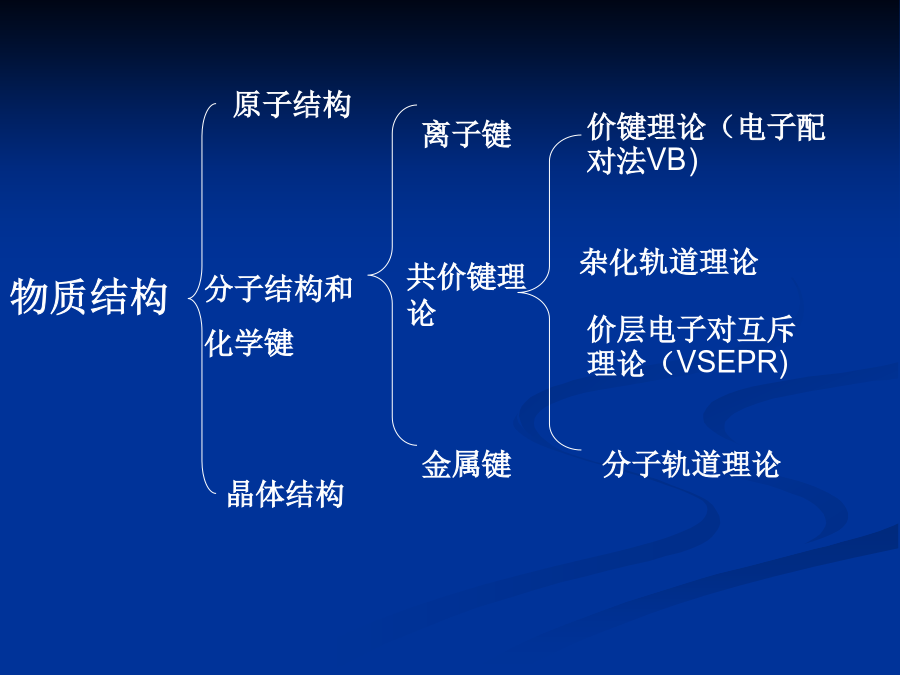
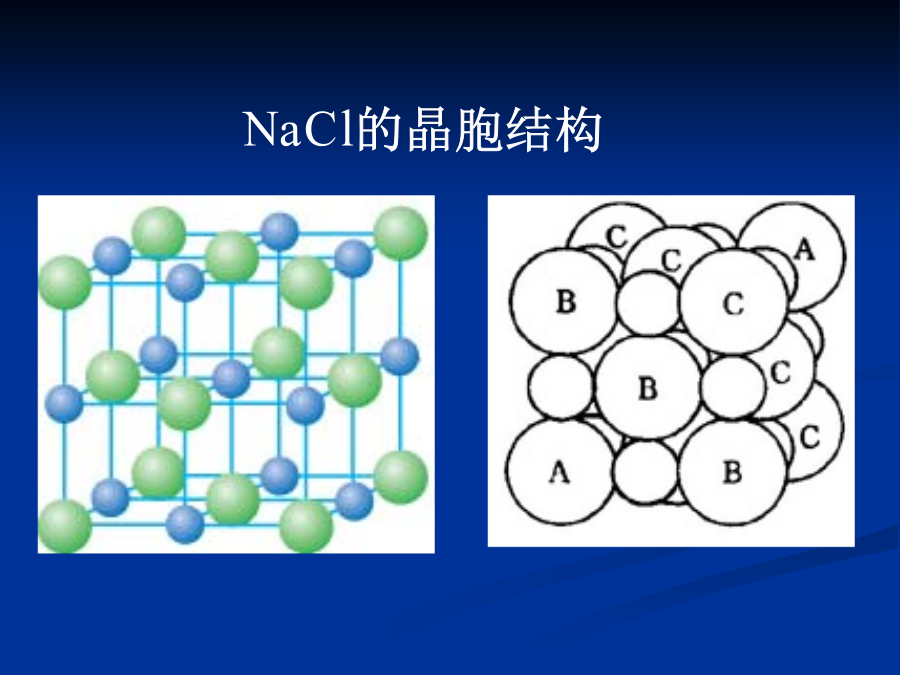
物质结构物质结构第四章化学键与分子结构一、离子键理论1.离子键的本质就是正、负离子间的静电作用。2.既无方向性,也无饱和性由于离子键是正负离子通过静电引力作用相连接的,从而决定了离子键的特点是既无方向性,也无饱和性。正负离子近似看作点电荷,所以其作用不存在方向问题。没有饱和性是指在空间条件许可的情况下,每个离子可吸引尽可能多的相反离子。NaCl晶体,其化学式仅表示Na离子与Cl离子的离子数目之比为1∶1,并不是其分子式,整个NaCl晶体就是一个大分子。NaCl的晶胞结构3.键的离子性与元素的电负性有关用

价键理论.ppt
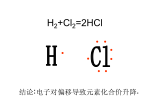
第2章7.认识分子间作用力和氢键的本质,会解释其对物质性质的影响。2.1化学键的定义Definitionofchemicalbond2.1化学键的定义DefinitionofchemicalbondPaulingL在《TheNatureofTheChemicalBond》中提出了用得最广泛的化学键定义:如果两个原子(或原子团)之间的作用力强得足以形成足够稳定的、可被化学家看作独立分子物种的聚集体,它们之间就存在化学键。简单地说,化学键是指分子内部原子之间的强相互作用力。2.已明确了的化学键类型(1)离子键
化合价升降或离子键与共价键.ppt
Na+

价键理论-上课.ppt
食品生物技术175001(一)新课引入:要使氢分子分解成氢原子,需要加热到2000℃,而且分解率还不够1%。概念要点:离子键演示实验:金属钠与氯气的反应钠与氯气的反应_氯离子的形成Na1.概念:3.过渡并设问引出电子式:a.原子的电子式:[练习1]写出下列微粒的电子式:硫原子,溴原子,硫离子,溴离子d:离子化合物的电子式:4、用电子式表示离子化合物的形成过程⑴用电子式表示KBr的形成过程小结:共价键23241S261.电子配对原理28共价键的类型4041练习1.在氟气分子中,形成共价键的原子轨道是()A、

123价键理论.ppt
12.3价键理论1927年海特勒(W.Heitler)和伦敦(F.W.London)首先将量子力学应用到分子结构中,1930年鲍林(L.Pauling)和德国物理学家斯莱特(J.C.Slater)有加以发展,建立了价键理论,简称VB理论(又称电子配对理论)。进一步阐明了价键本质。降低能量成键共价键的特点HHσ键:成键时两原子沿键轴(两个原子核的联线)方向,以“头碰头”的方式发生轨道重叠,轨道重叠的部分呈圆柱形对称。σ键:头碰头方式p-pπ键的形成N2中p-pσ键和p-pπ键的形成过程共价键饱和性和方向性根
