
简明无机化学酸碱和沉淀课件.ppt

和蔼****娘子








亲,该文档总共476页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

简明无机化学酸碱和沉淀课件.ppt
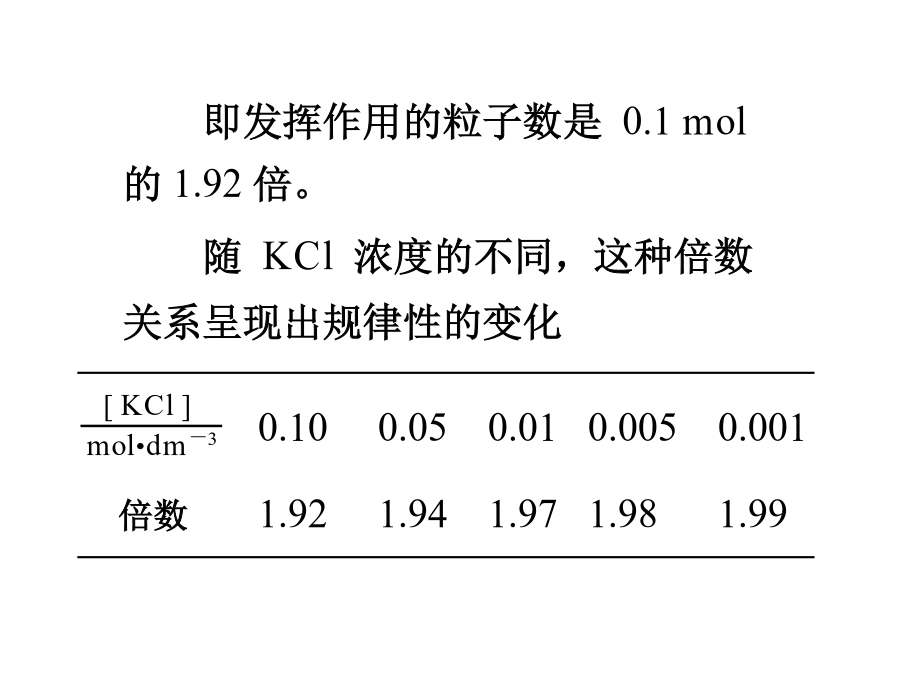
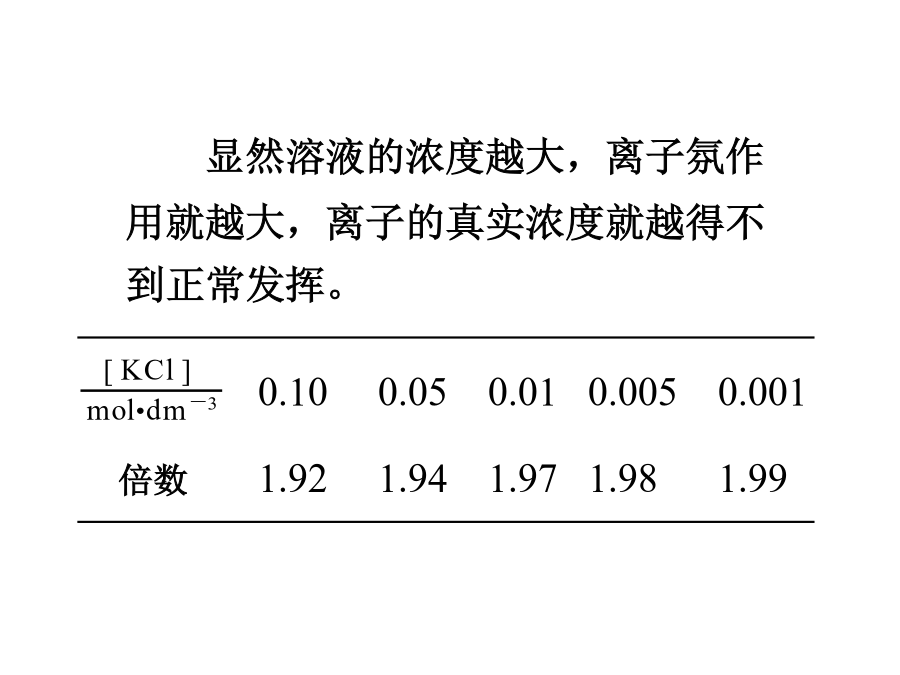
稀溶液依数性实验的结果表明,在1dm30.1mol•dm-3的蔗糖溶液中,能独立发挥作用的溶质的粒子是0.1mol。但是对于电解质溶液,情况则有所不同。随KCl浓度的不同,这种倍数关系呈现出规律性的变化数据既说明KCl在水溶液中发生解离,又说明这种解离是不完全的。KCl水溶液的导电性,说明解离的产物是离子。解离的方式是这一矛盾现象的发现,促进了电解质溶液理论的发展。1923年,荷兰人德拜(Debye)和德国人休克尔(Hückel)提出了强电解质溶液理论,成功地解释了上面提出的矛盾现象。4.1.1离子氛由于

天津大学无机化学03-酸碱反应和沉淀反应课件.ppt
无机化学多媒体电子教案祝同学们学习一帆风顺!卖油翁学习目标陈尧咨(善射)1、联系生活、学习,说说熟能生巧的事例。2、你认为一个人应该如何看待自己的长处?又如何看待他人的长处?人外有人,天外有天。取人之长,补己之短。自满人十事九空,虚心人万事可成。谦受益,满招损。1、正视自己的长处,扬长避短,2、正视自己的缺点,知错能改,3谦虚使人进步,4、人应有一技之长,5、自信是走向成功的第一步,6强中更有强中手,一山还比一山高,7艺无止境8、宝剑锋从磨砺出,梅花香自苦寒来,刻苦训练才能有所收获,取得成效。9、骄傲自大

酸碱平衡和沉淀溶解平衡.pptx
123456789101112131415161718192021222324252627282930313233343536373839404142434445464748495051525354555657585960616263646566676869707172737475767778798081828384858687888990919293949596979899100101102103104105106107108109

酸碱和沉淀 (4-3).ppt
§4-4酸碱理论的发展一、酸碱电离理论(水-离子理论)28岁的瑞典科学家S.Arrhenius于1887年提出。二、酸碱溶剂理论1905年E.C.Franklin(富兰克林)在水-离子理论的基础上提出的。三、酸碱质子理论1923年由丹麦化学家Brønsred(布朗斯特)和英国化学家Lowry(劳莱)提出。四、酸碱电子理论1923年,由美国物理化学家Lewis提出,又称“Lewis”酸碱理论。五、酸碱软硬理论1963年R.G.Pearson(皮尔逊)提出的一种路易斯酸碱的分类方法。4-1酸碱电离理论三、酸碱

简明无机化学卤素课件.ppt
第八章卤素氯Cl主要以氯化钠的形式存在于海水、盐湖、盐井中。溴Br主要存在于海水中,盐湖和盐井中也存在少量的溴。碘I碘在海水中存在的更少,主要被海藻所吸收。碘也存在于某些盐井、盐湖中。南美洲智利硝石含有少许的碘酸钠。砹At砹属于放射性元素,不列为本章研究内容。8.1卤素单质F2Cl2Br2I22.颜色浅黄黄绿红棕紫为什么Cl2吸收能量高的紫光,Br2吸收能量居中的蓝绿光,而I2却吸收能量较低的黄绿光?卤素单质的双原子分子轨道图卤素吸收部分可见光,以满足电子从最高占有轨道*,向最低空轨道*跃迁所需的能量
