
量子力学对原子核外电子运动状态的描述.pptx

kp****93




在线预览结束,喜欢就下载吧,查找使用更方便
相关资料
量子力学对原子核外电子运动状态的描述.pptx
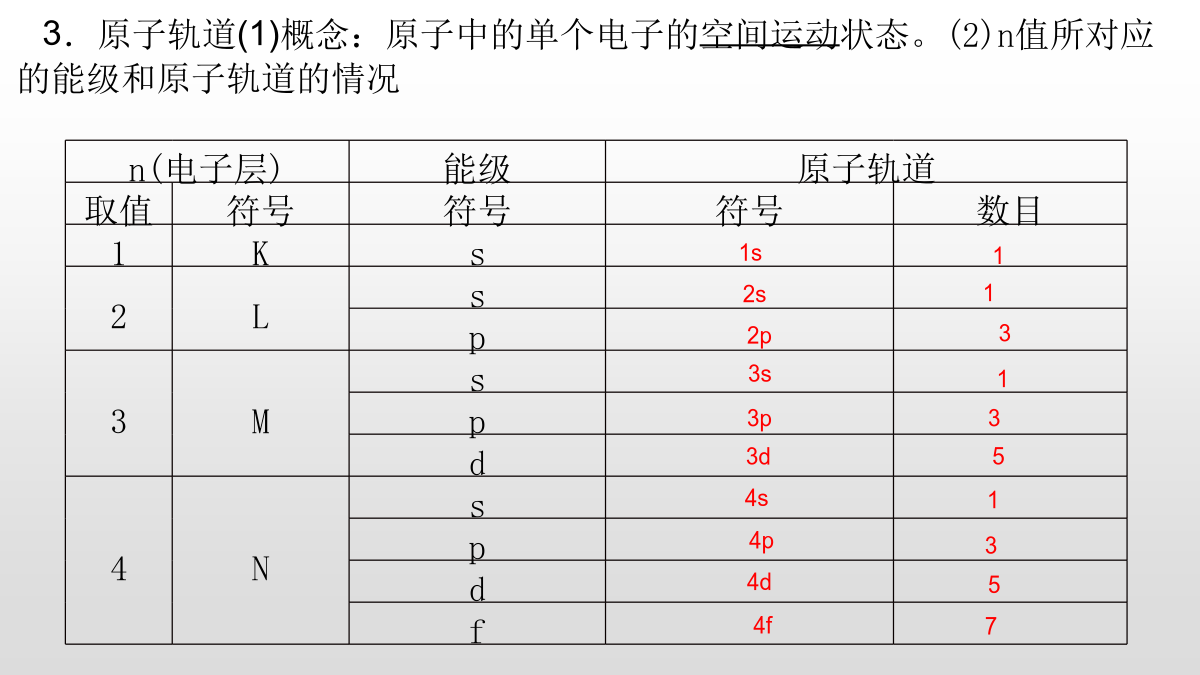
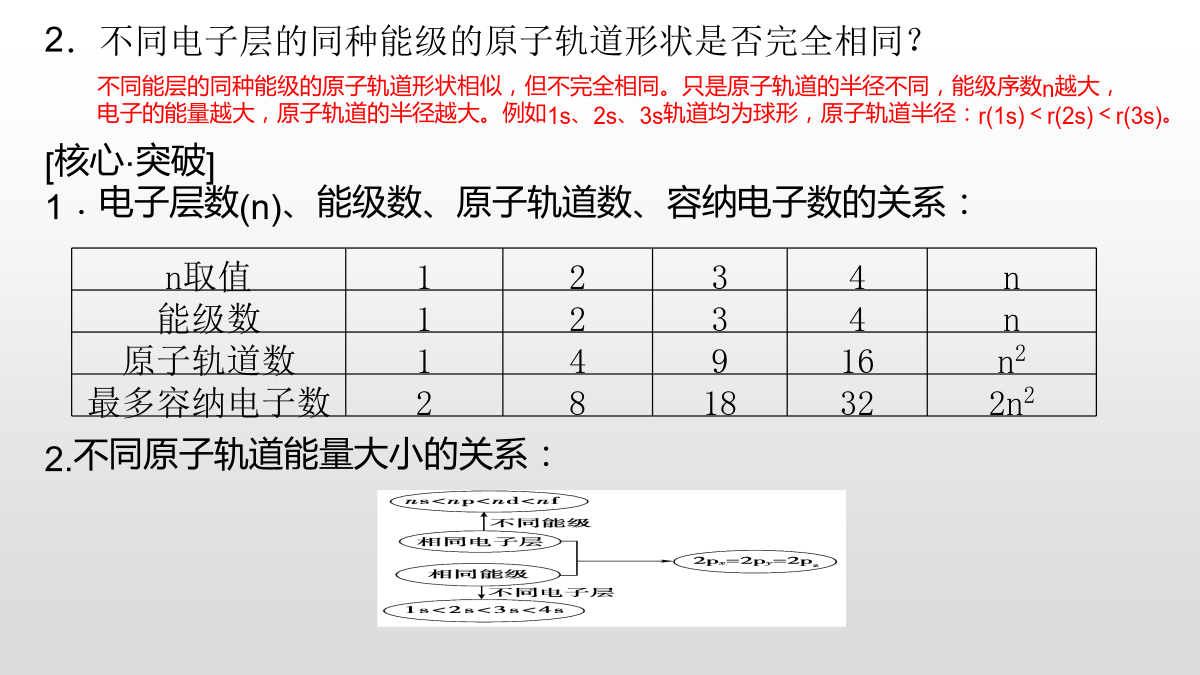
量子力学对原子核外电子运动状态的描述[基础·初探]教材整理1原子轨道1.电子层2.能级在同一电子层中,电子所具有的能量可能不同,所以同一电子层可分成不同的能级,用s、p、d、f表示。3.原子轨道(1)概念:原子中的单个电子的空间运动状态。(2)n值所对应的能级和原子轨道的情况4.自旋运动状态处于同一原子轨道上的电子自旋运动状态只有两种,分别用符号“↑”和“↓”表示。练习:(1)离核越近的电子,能量越低。()(2)第n电子层共有n个能级,n2个原子轨道。()(3)每个轨道容纳的2个电子自旋方向不固定。()(

量子力学对原子核外电子运动状态的描述.docx
量子力学对原子核外电子运动状态的描述1.下列有关认识正确的是()A.各能级的原子轨道数按s、p、d、f顺序依次为1、3、5、7B.各电子层的能级都是从s能级开始至f能级结束C.各电子层含有的能级数为n-1D.各电子层含有的电子数为2n2个【解析】各电子层的能级数等于其所处的电子层数,即当n=1时,它只有一个s能级,当n=2时,它有两个能级:s能级和p能级,所以B、C均错误;而每个电子层最多容纳的电子数为2n2个。【答案】A2.某元素原子的核外有三个电子层,最外电子层有4个电子,该原子核内的质子数为()A.

量子力学对原子核外电子运动状态的描述 (2).docx
量子力学对原子核外电子运动状态的描述1.下列有关认识正确的是()A.各能级的原子轨道数按s、p、d、f顺序依次为1、3、5、7B.各电子层的能级都是从s能级开始至f能级结束C.各电子层含有的能级数为n-1D.各电子层含有的电子数为2n2个【解析】各电子层的能级数等于其所处的电子层数,即当n=1时,它只有一个s能级,当n=2时,它有两个能级:s能级和p能级,所以B、C均错误;而每个电子层最多容纳的电子数为2n2个。【答案】A2.某元素原子的核外有三个电子层,最外电子层有4个电子,该原子核内的质子数为()A.
量子力学对原子核外电子运动状态的描述 (2).pptx
量子力学对原子核外电子运动状态的描述[基础·初探]教材整理1原子轨道1.电子层2.能级在同一电子层中,电子所具有的能量可能不同,所以同一电子层可分成不同的能级,用s、p、d、f表示。3.原子轨道(1)概念:原子中的单个电子的空间运动状态。(2)n值所对应的能级和原子轨道的情况4.自旋运动状态处于同一原子轨道上的电子自旋运动状态只有两种,分别用符号“↑”和“↓”表示。练习:(1)离核越近的电子,能量越低。()(2)第n电子层共有n个能级,n2个原子轨道。()(3)每个轨道容纳的2个电子自旋方向不固定。()(

高中化学 1.1.2 量子力学对原子核外电子运动状态的描述课件 鲁科选修3.ppt
1111111探究一探究一探究一探究一探究一探究一探究一探究一探究一探究一探究一探究一探究一探究一探究一探究一探究一探究一探究一探究一探究一探究一
