
探究实验设计.ppt

dc****76








亲,该文档总共13页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

探究实验设计.ppt
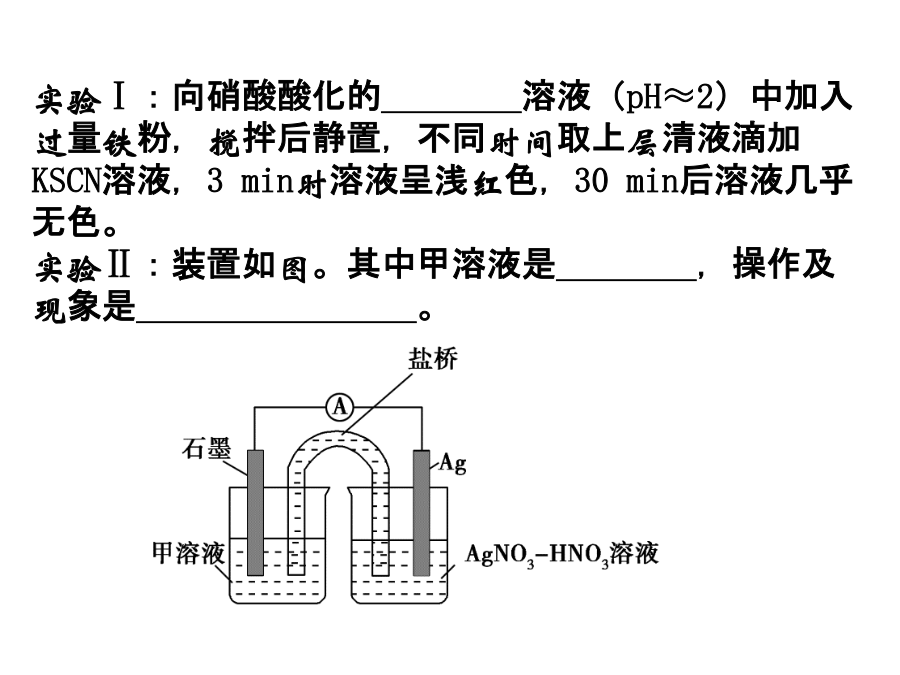
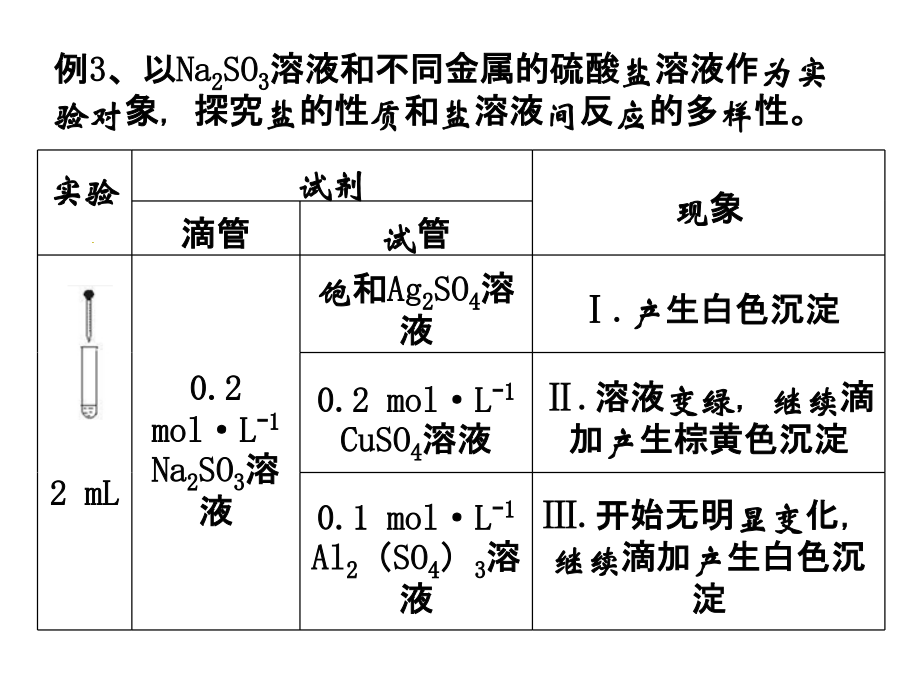
探究实验设计某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:(1)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为______________。(2)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是_____________________。(3)丙组同学向盛有H2O2溶液的试管中加入几滴酸

综合实验设计的探究.ppt
演示课件;综合实验设计的探究内容提要一、几种常见的简单装置3、尾气处理4、量气装置二、常见气体的验证与除杂CO:答:不能,无水CuSO4变蓝可能是由于原混合气体中的水蒸气造成的,因此在验证H2前要排除H2O的干扰。三、装置连接顺序课堂练习(2)确认混合气体中含有H2的实验现象是:根据上列装置图用序号回答:(1)根据实验现象能直接证明CO中含CO2应将气体通过_装置;(2)为验证CO2中含有少量的CO可将气体通过装置;(3)为准确测定水的组成,用锌粒与盐酸反应制得的氢气还原氧化铜,并对生成的水进行称量。为防

探究实验设计之燃烧条件的探究.doc
探究实验设计之燃烧条件的探究探究实验设计之燃烧条件的探究1.化学反应原理①磷在空气中燃烧:;②木炭在氧气中燃烧:2.实验仪器:烧杯、导管、铜片、双连球、贮气瓶、塑料洗瓶等实验药品:白磷、红磷、木炭等3.探究方案方案⑴:在250mL的烧杯中放入一小块白磷,并注入200mL的热水。在烧杯上盖一片薄铜片,铜片一端放一小块已用滤纸吸去表面水分的白磷,另一端放一小堆干燥的红磷。如图19-1。过一会,铜片上的白磷因满足燃烧的条件而燃烧,热水中的白磷因没有跟氧气接触而不能燃烧,铜片上的红磷因没有达到着火点而不能燃烧(白

探究实验设计之分子运动的探究.doc
探究实验设计之分子运动的探究探究实验设计之分子运动的探究1.化学反应原理浓氨水具有较强的挥发性,氨气溶于水,与水反应生成弱碱性的一水合氨电离出氢氧根离子。遇酚酞试液后,酚酞试液变红色。2.实验仪器:烧杯。实验药品:浓氨水、酚酞试液。3.探究方案:如图10-1所示,在A、B烧杯中加入约三分之一容积的蒸馏水,滴加数滴酚酞试液,在C烧杯中倒入约10mL浓氨水,用大烧杯罩住A、C烧杯,观察。一会儿后,可见A烧杯中溶液变红色,B溶液不变色。4.探究评价:该实验现象明显,操作简便,是比较好的实验方案。但缺点是,由于浓

探究实验设计之对蜡烛及其燃烧的探究.doc
探究实验设计之对蜡烛及其燃烧的探究探究实验设计之对蜡烛及其燃烧的探究1.化学反应原理蜡烛由石蜡和绵芯组成,主要反应是石蜡与空气中的氧气发生的氧化反应。石蜡的主要成分是固态烷烃类物质的混合物,其中二十二碳烷和二十八碳烷含量最高。反应过程中,伴随有熔化、放热、发光等现象。由于石蜡中固态烷烃中碳的质量分数高,在空气中较难充分燃烧,故反应过程中有少量的黑烟生成。烛焰也分三层,最内层几乎不能接触空气(氧气),没有发生燃烧,故焰心部分基本上由石蜡蒸气组成,颜色很浅,呈浅蓝色;中间部分接触空气(氧气),但接触不充分,产
