
常见非金属元素单质10.ppt

sy****28






亲,该文档总共59页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

常见非金属元素单质10.ppt
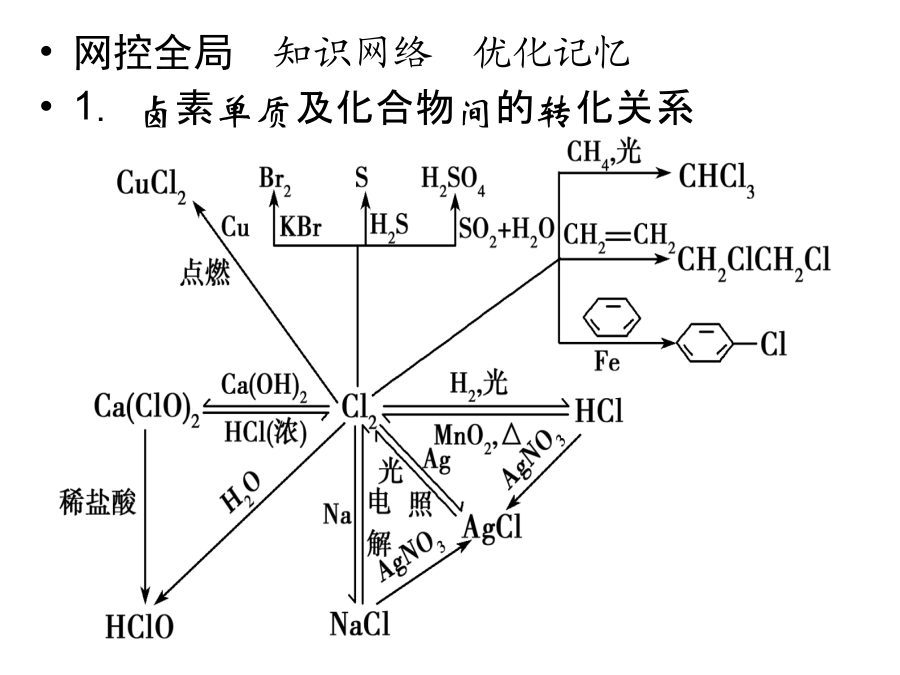
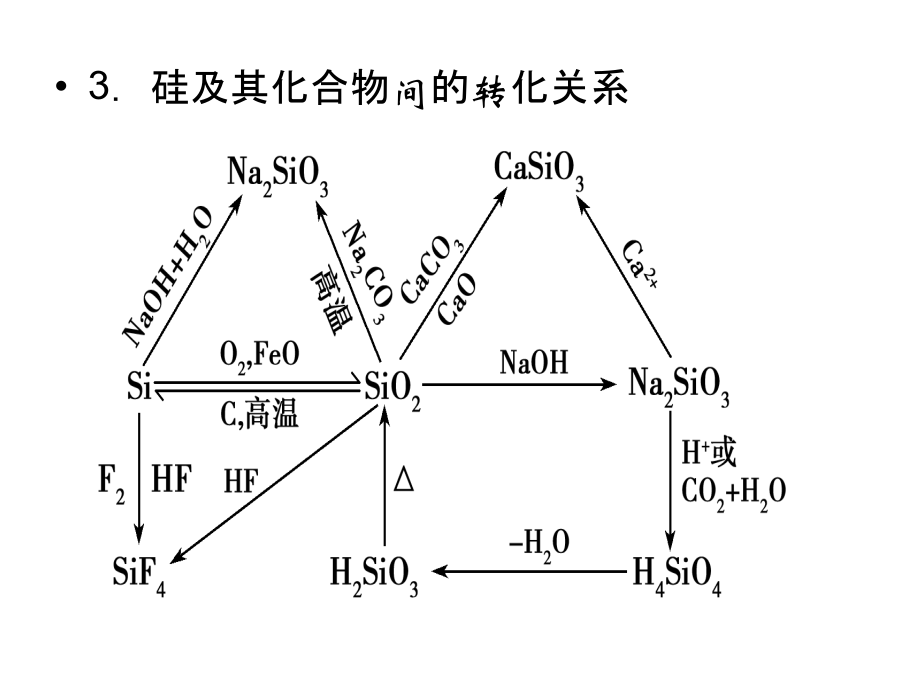
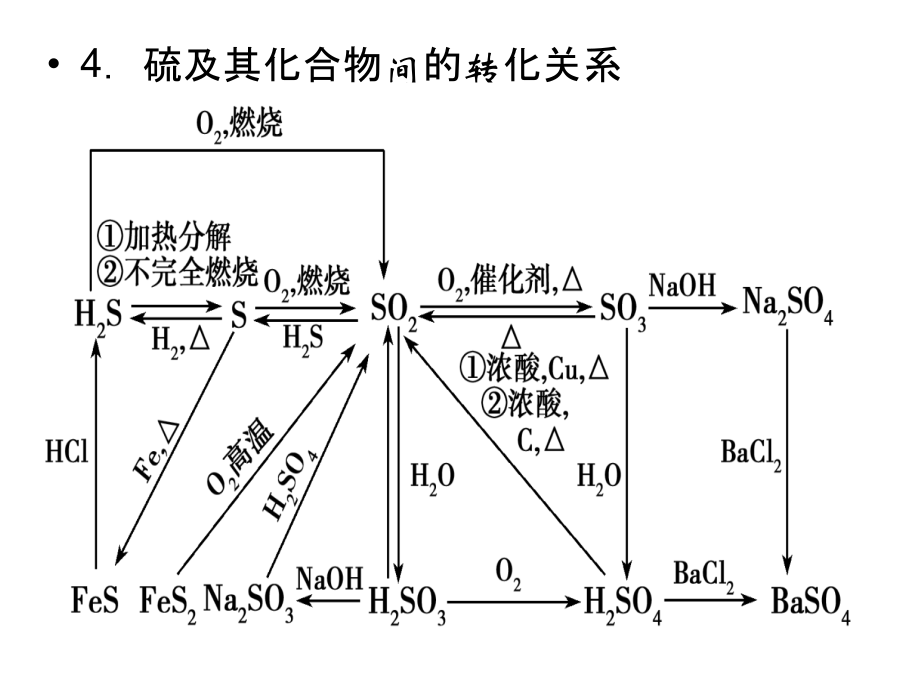
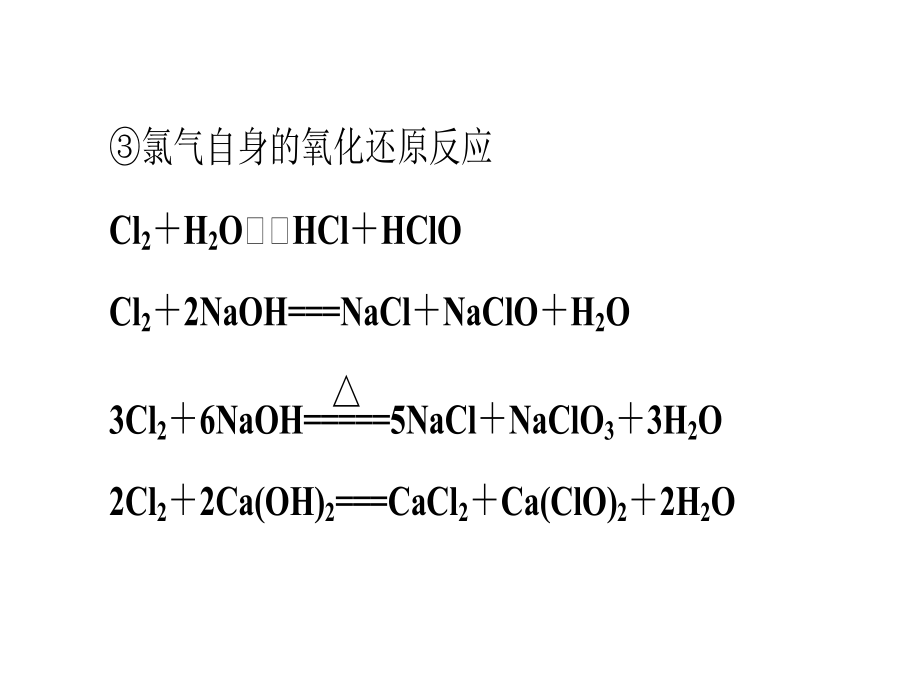
常见非金属元素单质及其重要化合物考纲解读1.了解常见非金属元素(C、N、O、Si、S、Cl等)单质及其重要化合物的主要性质及应用。2.了解常见非金属元素单质及其重要化合物对环境质量的影响。3.了解以上各部分知识的综合应用。网控全局知识网络优化记忆1.卤素单质及化合物间的转化关系2.碳及其化合物间的转化关系3.硅及其化合物间的转化关系4.硫及其化合物间的转化关系5.氮及其化合物间的转化关系考点整合高效提升触类旁通1.卤素及其化合物(1)氯气的氧化性①氯气氧化金属单质绝大多数的金属单质能在一定条件下被氯气氧化

常见的碳单质.ppt
例4(2013·衡阳)我市中考实行网上阅卷,答题时必须用2B铅笔填涂答题卡,2B铅笔芯的主要成分是()A.石墨B.金刚石C.木炭D.C60解析:石墨是深灰色的、质软、有滑腻感,它在纸上划过会留下灰色的痕迹,故石墨可以用来制铅笔芯。答案:A例5(2013·重庆)激光打印机是常见的办公用品,它所用墨粉的主要成分是极细的碳粉。(1)碳粉不具有的性质是____________(填序号)。A.黑色B.易溶于水C.可燃性D.常温下稳定(2)将碳粉与氧化铜混合后加强热,发生反应的化学方程式为______________

常见的碳单质.ppt
例4(2013·衡阳)我市中考实行网上阅卷,答题时必须用2B铅笔填涂答题卡,2B铅笔芯的主要成分是()A.石墨B.金刚石C.木炭D.C60解析:石墨是深灰色的、质软、有滑腻感,它在纸上划过会留下灰色的痕迹,故石墨可以用来制铅笔芯。答案:A例5(2013·重庆)激光打印机是常见的办公用品,它所用墨粉的主要成分是极细的碳粉。(1)碳粉不具有的性质是____________(填序号)。A.黑色B.易溶于水C.可燃性D.常温下稳定(2)将碳粉与氧化铜混合后加强热,发生反应的化学方程式为______________

常见碳的几种单质.ppt
常见碳的几种单质金刚石石墨常见碳的几种单质焦炭活性炭C60纯净的金刚石是一种无色透明的、正八面体形状的固体,坚硬是金刚石最重要的性质。石墨是一种深灰色的有金属光泽而不透明的细鳞片状固体。石墨是最软的矿物之一石墨具有优良的导电性能,耐高温金刚石和石墨的物理性质及用途石墨的结构金刚石和石墨是可以相互转化的,发生的是?木炭活性炭的用途木炭活性炭焦炭炭黑C60分子是由60个碳原子构成的分子。形似足球,很稳定反映5、俗话说“没有金刚钻,少揽瓷器活”这句话反映了金刚石的()A硬度大B光泽好6、现代战争中使用的石墨炸弹

几种常见的碳单质.ppt
第六单元碳和碳的化合物国画不同元素可以构成不同的物质。一、碳的单质一、碳的单质一、碳的单质一、碳的单质练习人造金刚石和金刚石薄膜一、碳的单质电子显微镜下看到的木炭结构木炭的用途一、碳的单质4.C60——神奇的碳单质分子一、碳的单质一、碳的单质练习2练习3(1)————;(2)————;(3)————。5、继发现C60后C70也已经制得,下列有关C70的说法正确的是()如下图所示,中盛有红棕色二氧化氮气体的集气瓶里放几小块活性炭,最终观察到红棕色(填“变深”或“消失”或“不变”),漏斗中液面(填“上升”或“
