
专题1(教师)物质的组成、性质和分类 化学用语.doc

增梅****主啊




在线预览结束,喜欢就下载吧,查找使用更方便
相关资料

专题1(教师)物质的组成、性质和分类 化学用语.doc
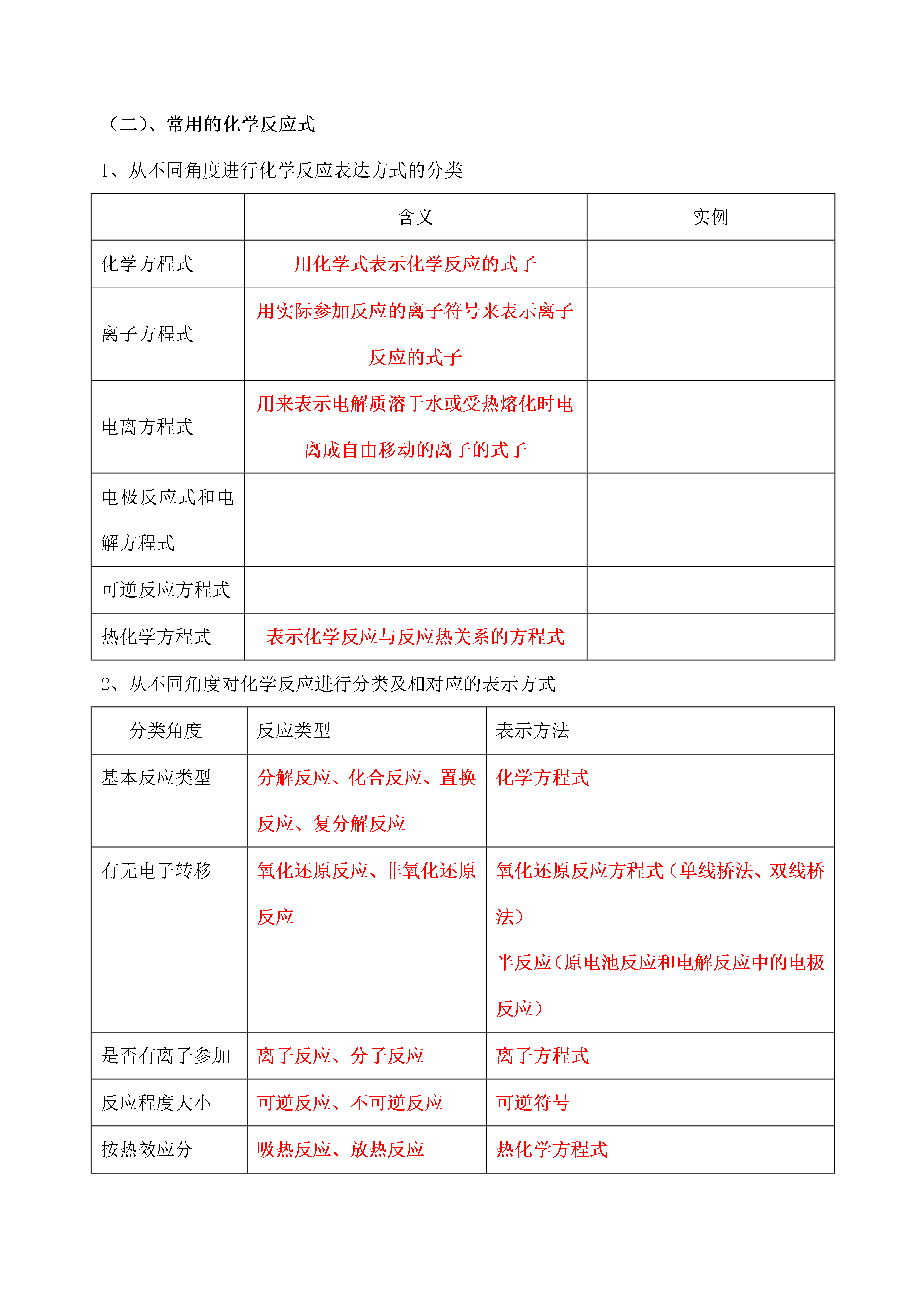
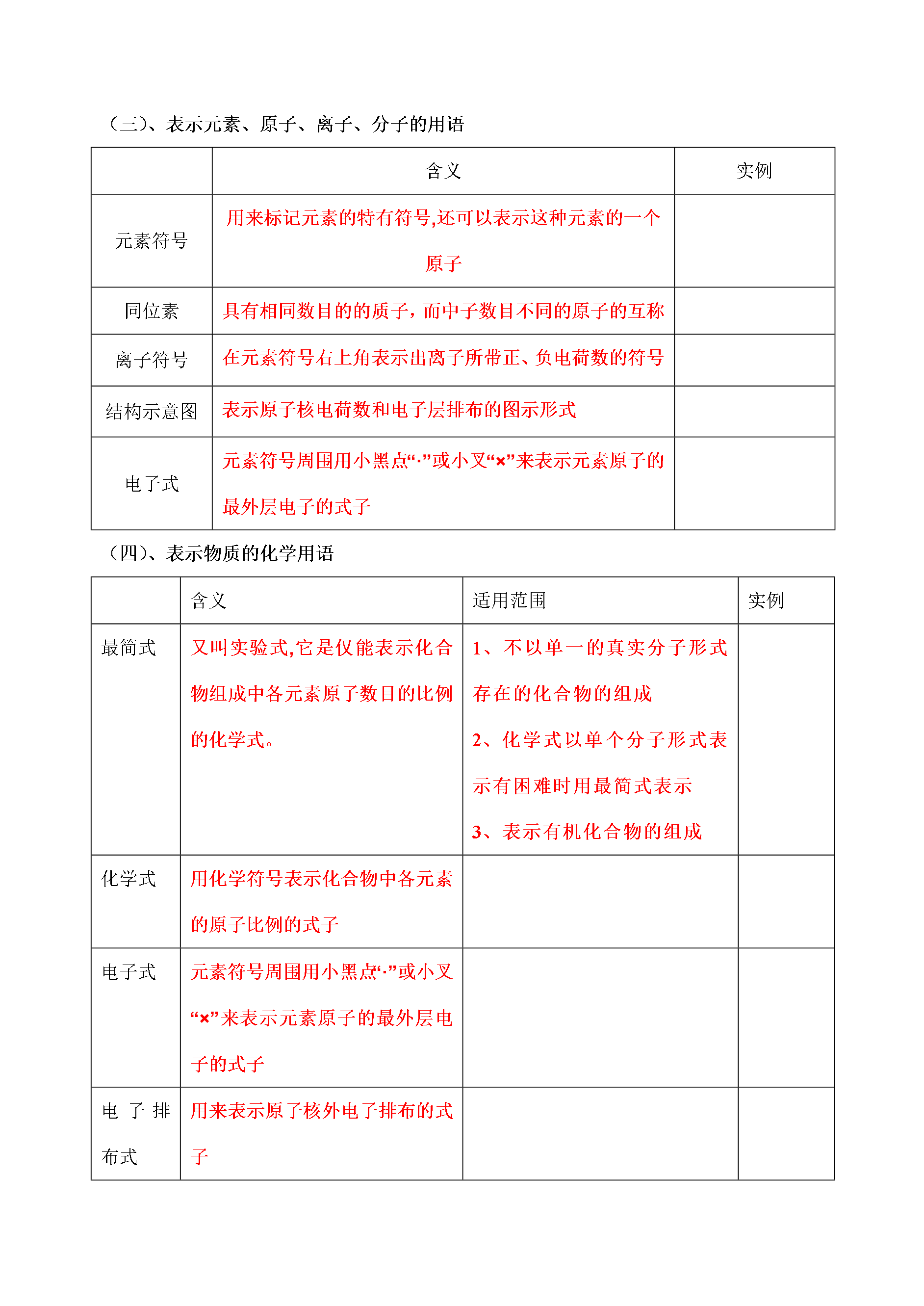
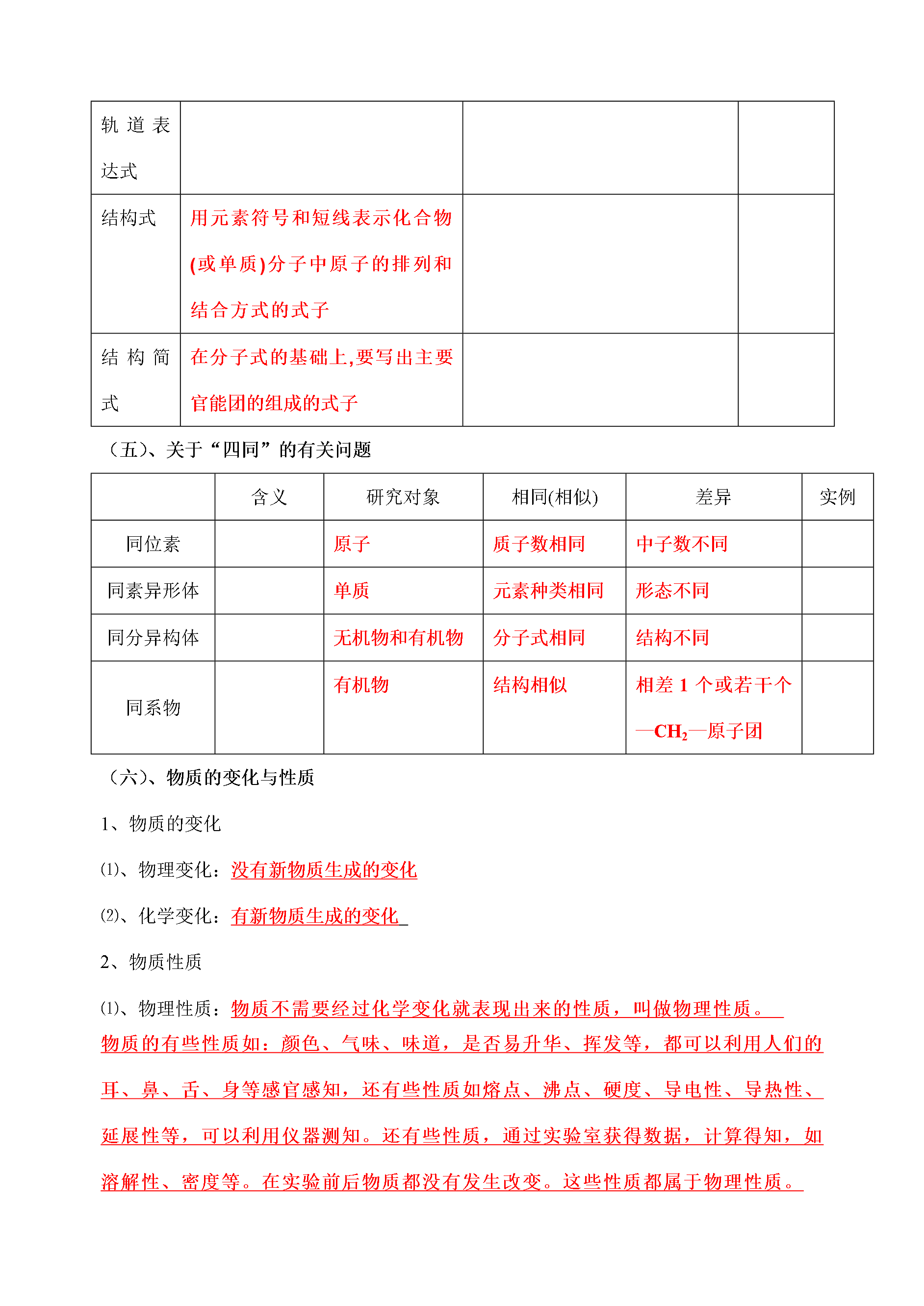
高三化学学科一体化教学案编写人景均编号105课时105—化学基本概念专题1物质的组成、性质和分类化学用语一、考纲要求:1.高考试题中常用选择题来考查考生对同素异形体、同分异构体、同位素和核素、无机反应和有机反应的分类、化合价、原子结构等基本概念的理解程度。高考中常会以化学学科中的重要概念来考测考生对化学基础概念的理解和辩折能力。2.无论是基础型试题还是能力型试题问题的答案大多会要求考生用化学方程式、离子方程式、热化学方程式、化学式、结构简式等基本化学用语来表述答案每年

专题1(教师)物质的组成、性质和分类 化学用语.doc
高三化学学科一体化教学案编写人景均编号105课时105—化学基本概念专题1物质的组成、性质和分类化学用语一、考纲要求:1.高考试题中常用选择题来考查考生对同素异形体、同分异构体、同位素和核素、无机反应和有机反应的分类、化合价、原子结构等基本概念的理解程度。高考中常会以化学学科中的重要概念来考测考生对化学基础概念的理解和辩折能力。2.无论是基础型试题还是能力型试题问题的答案大多会要求考生用化学方程式、离子方程式、热化学方程式、化学式、结构简式等基本化学用语来表述答案每年

专题1(学生) 物质的组成、性质和分类 化学用语.doc
高三化学学科一体化教学案编写人景均编号105课时105—化学基本概念专题1物质的组成、性质和分类化学用语一、考纲要求:1.高考试题中常用选择题来考查考生对同素异形体、同分异构体、同位素和核素、无机反应和有机反应的分类、化合价、原子结构等基本概念的理解程度。高考中常会以化学学科中的重要概念来考测考生对化学基础概念的理解和辩折能力。2.无论是基础型试题还是能力型试题问题的答案大多会要求考生用化学方程式、离子方程式、热化学方程式、化学式、结构简式等基本化学用语来表述答案每年

专题1(学生) 物质的组成、性质和分类 化学用语.doc
高三化学学科一体化教学案编写人景均编号105课时105—化学基本概念专题1物质的组成、性质和分类化学用语一、考纲要求:1.高考试题中常用选择题来考查考生对同素异形体、同分异构体、同位素和核素、无机反应和有机反应的分类、化合价、原子结构等基本概念的理解程度。高考中常会以化学学科中的重要概念来考测考生对化学基础概念的理解和辩折能力。2.无论是基础型试题还是能力型试题问题的答案大多会要求考生用化学方程式、离子方程式、热化学方程式、化学式、结构简式等基本化学用语来表述答案每年

专题一 物质的组成、性质、分类及化学用语.doc
专题一物质的组成、性质、分类及化学用语说明:下列叙述中,正确的在括号内打“√”,错误的在括号内打“×”。1.Na2CO3既属于钠盐又属于碳酸盐,这是交叉分类法。根据物质所含分子种类的多少,可将物质分为纯净物和混合物;根据组成元素的种类,纯净物又分为单质和化合物,这是树状分类法。()2.化合物既可以分为酸、碱、盐和氧化物,又可分为电解质和非电解质。()3.含有一种分子的物质是纯净物,冰水混合物属于纯净物。()4.元素分为金属元素和非金属元素,硅单质具有金属光泽,但硅元素属于非金
