
高考化学一轮复习 5.1 原子结构 原子核外电子排布课件 苏教版-苏教版高三全册化学课件.ppt

书生****萌哒









亲,该文档总共27页,到这已经超出免费预览范围,如果喜欢就直接下载吧~
相关资料

高考化学一轮复习 5.1 原子结构 原子核外电子排布课件 苏教版-苏教版高三全册化学课件.ppt
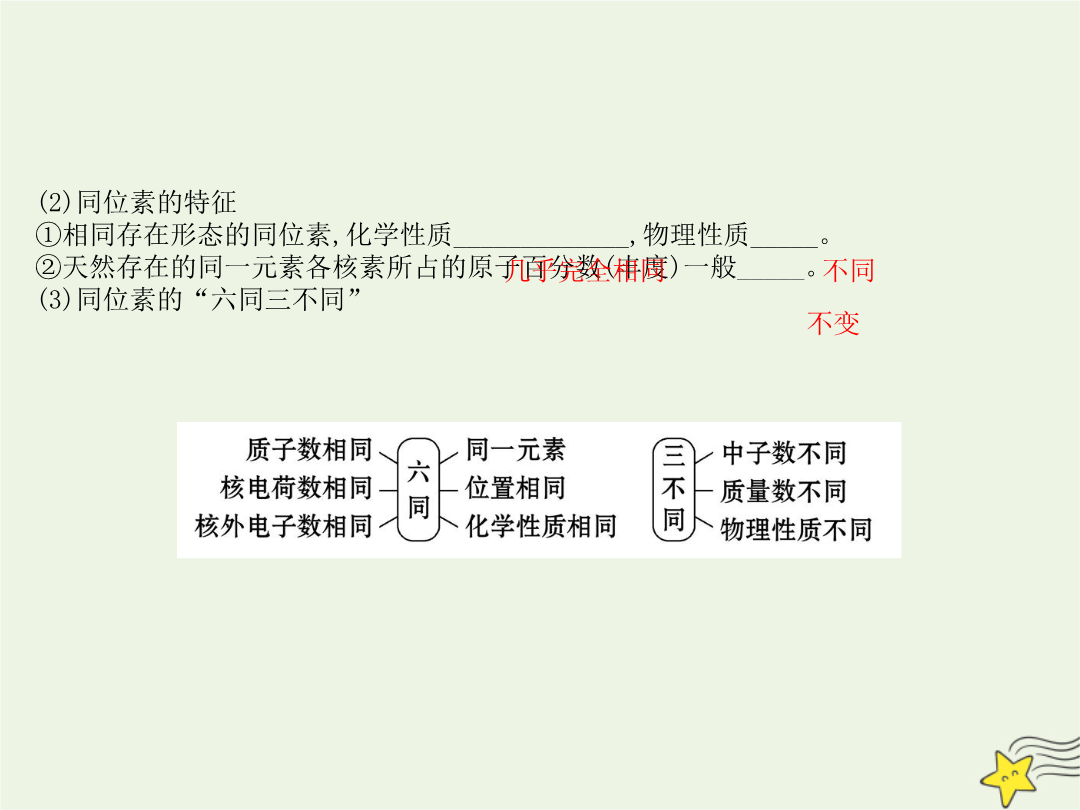
考点1:原子结构与核素、同位素【核心知识自查】1.原子结构(1)原子的构成粒子(2)构成原子或离子的微粒间的数量关系①原子中:质子数(Z)=核电荷数=___________。②质量数(A)=质子数(Z)+中子数(N)。③阳离子的核外电子数=质子数-_______所带电荷数。如Mg2+的核外电子数是10。④阴离子的核外电子数=质子数+_______所带电荷数。如Cl-的核外电子数是18。(3)一个信息丰富的符号2.核素、同位素(1)概念辨析(2)同位素的特征①相同存在形态的同位素化学性质_________

高考化学一轮复习 5.1 原子结构 原子核外电子排布练习(含解析)苏教版-苏教版高三全册化学试题.doc
原子结构原子核外电子排布在国家自然科学基金项目和中国地质调查局能源矿产调查项目的联合资助下我国学者发现自然界新矿物——Taipingite-(Ce)(太平石)是一种含氟稀土硅酸盐矿物晶体化学式为(Ce7Ca2)Σ9Mg(SiO4)3[SiO3(OH)]4F3属于三方晶系空间群R3c晶胞参数a=10.7246(3)Åc=37.953(1)ÅZ=6。其结构如下:太平石的发现不仅丰富了我国稀土矿物种类与研究资料对深入研究稀土矿的矿床成因和提升矿床价值具有重要意义同时也会为人工合成稀土纳米材料技术提供新的参考

高考化学一轮复习 5.1 原子结构 原子核外电子排布课件 新人教版-新人教版高三全册化学课件.ppt
考点1:原子结构与核素、同位素【核心知识自查】1.原子结构(1)原子的构成粒子(2)构成原子或离子的微粒间的数量关系①原子中:质子数(Z)=核电荷数=___________。②质量数(A)=质子数(Z)+中子数(N)。③阳离子的核外电子数=质子数-_______所带电荷数。如Mg2+的核外电子数是10。④阴离子的核外电子数=质子数+_______所带电荷数。如Cl-的核外电子数是18。(3)一个信息丰富的符号2.核素、同位素(1)概念辨析(2)同位素的特征①相同存在形态的同位素化学性质_________

高三化学一轮复习 专题5 第1单元 原子结构 核外电子排布课件 苏教版-苏教版高三全册化学课件.ppt
课时分层训练原子核电荷数氢弹考点2|核外电子排布电子核

高三化学一轮复习 专题5 第1单元 原子结构 核外电子排布课件 苏教版-苏教版高三全册化学课件.ppt
课时分层训练原子核电荷数氢弹考点2|核外电子排布电子核
